| 时间:2026-01-08 |
2025年发表于《Chemical Engineering Journal》(IF=13.2)
一、研究背景
代谢功能障碍相关脂肪性肝病(MASLD)是全球最普遍的慢性肝病,其发病机制复杂,涉及脂质代谢紊乱、严重氧化应激和炎症(即“多重打击”学说)。目前缺乏能同时针对核心致病因素(抑制脂质合成、促进脂质外排、清除ROS)的通用药物。MOF-818是一种含三核铜的金属有机框架(MOF),具有超氧化物歧化酶(SOD)和过氧化氢酶(CAT)模拟活性,可清除ROS。ASGR1受体在肝细胞表面高表达,其抗体可激活LXRα促进脂质外排;UDPG(尿苷二磷酸葡萄糖)则能抑制SREBP1c介导的脂肪新生。然而,两者单独使用存在稳定性差、靶向性不足等问题。为此,本研究设计并构建了多功能纳米酶MOF-818@UDPG/ASGR1,旨在通过“双通道脂质调节 + ROS清除”实现协同治疗。
二、研究结果
1、纳米酶设计与作用机制示意图
展示了纳米酶的结构组成(MOF-818 核心 + UDPG 载荷 + ASGR1 抗体表面修饰)及其作用通路:ASGR1抗体靶向肝细胞并激活LXRα促进脂质外排;UDPG进入高尔基体降解S1P,抑制SREBP1c介导的脂肪新生;MOF-818核心清除ROS(图1)。
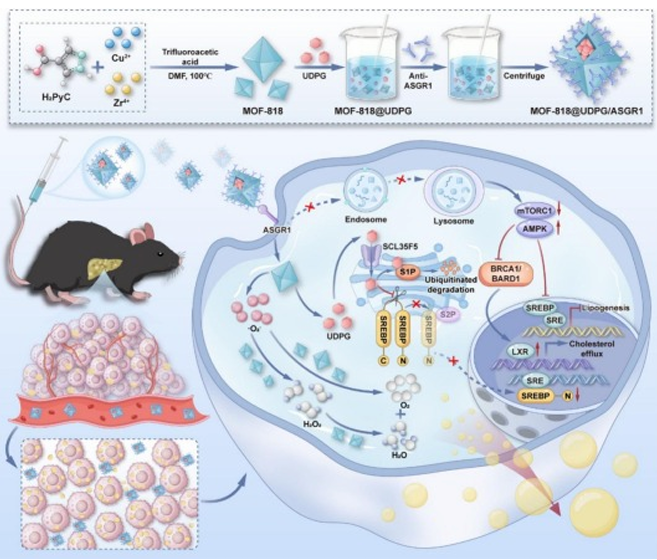
图1 MOF-818 @ UDPG / ASGR1纳米酶通过双通道调脂和清除ROS协同治疗肝脏脂肪变性的示意图
2、MOF-818@UDPG/ASGR1 的合成与表征
采用溶剂热法合成MOF-818,再负载UDPG并偶联ASGR1抗体,且观察到MOF-818 呈现规则的八面体结构,功能化后结构仍保持完整,粒径约为 133.2 nm(图2A-B)。元素映射证实C、N、O、Zr、Cu均匀分布,P 元素分布于表面(图2C)。XRD显示功能化后晶格结构保持完整(图2D)。FT-IR显示UDPG特征峰出现(图2E)。与MOF - 818相比,MOF-818 @ UDPG / ASGR1的Zeta电位显著降低,证明UDPG和ASGR1成功负载(图2F)。从多个维度全面验证了纳米酶的成功制备,证明其结构稳定、功能组分高效负载、具备良好胶体特性,为后续生物学实验提供了坚实的材料基础。
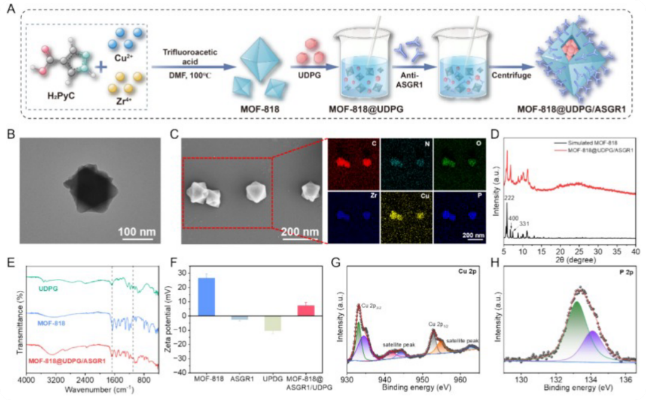
图2 MOF-818@UDPG/ASGR1 的合成与表征
3、MOF-818@UDPG/ASGR1 的多酶模拟活性
通过NBT还原实验和EPR波谱验证SOD活性,发现MOF-818@UDPG/ASGR1能有效清除超氧阴离子(图3A–E)。通过H₂O₂分解产O₂实验验证CAT活性,结果显示pH与温度稳定性良好(图3F–I)。这些数据表明,尽管经过功能化修饰,纳米酶依然保留强大的 SOD/CAT 双类酶活性,能够在病理环境中持续中和活性氧,是实现“抗氧化保护”的核心机制保障。
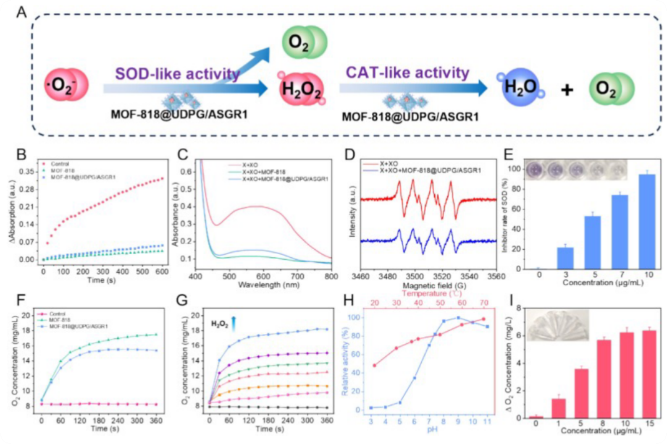
图3 MOF-818@UDPG/ASGR1 的多酶模拟活性
4、MOF-818@UDPG/ASGR1 的生物相容性
为了全面评价MOF - 818 @ UDPG / ASGR1的长期生物安全性,进行了系统的体内毒理学评价。健康小鼠尾静脉注射MOF - 818 @ UDPG / ASGR1 ( 10μg / mL、200 μ L)后,与对照组(给予等体积生理盐水)相比,其主要脏器(心、脑、脾、肺、肾、肝)经H&E 染色未见明显病理损伤(图4A)。此外,在MOF - 818 @ UDPG / ASGR1完成1周治疗后4周,对MASLD小鼠模型进行了全面的血清分析,结果显示,血清生化指标(ALT, AST, CRE 等)及炎症因子水平与对照组无异,表明体内安全性良好(图4B)。该研究结果表明,MOF-818 @ UDPG / ASGR1不会导致可检测的急性或长期毒性,肯定了其在体内应用的出色的生物安全性。
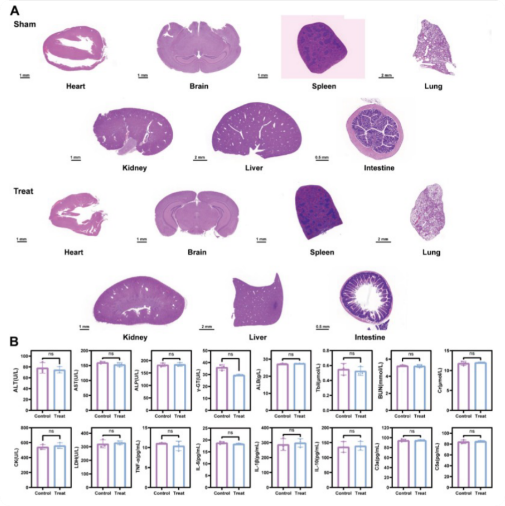
图4 对MOF - 818 @ UDPG / ASGR1进行全面的体内生物安全性评价
5、ASGR1介导的MOF - 818 @ UDPG / ASGR1对肝细胞的主动靶向
靶向递送至肝细胞是治疗策略的基石,通过使用共聚焦激光扫描显微镜( CLSM )和流式细胞术来定量评估ASGR1抗体的靶向能力,结果显示ASGR1介导的肝细胞靶向性增强(图5A-C)。UDPG(绿色)与高尔基体荧光(红色)高度重合,证实其被精准递送至作用位点(图5D)。小鼠活体成像显示纳米材料在肝脏富集(图5E, F)。以上数据说明MOF - 818 @ UDPG / ASGR1纳米酶实现了对肝细胞的高效和特异性靶向,确保治疗剂优先传递到损伤的原发部位。
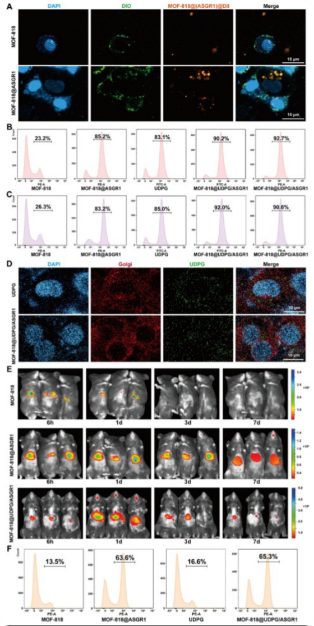
图5 ASGR1介导的MOF - 818 @ UDPG / ASGR1的肝细胞靶向和亚细胞递送
6、MOF-818 @ UDPG / ASGR1的体外细胞研究
在HeLa细胞上进行了活/死细胞共染实验(钙黄绿素-AM / PI ),结果显示MOF-818保护细胞免受H₂O₂损伤(图6A)。油红O染色显示MOF-818@UDPG/ASGR1脂滴积累减少最为显著(图6B)。DCFH-DA 探针检测 ROS 水平,结果显示该纳米酶能最有效地降低细胞内氧化应激(图6C)。流式细胞术显示纳米酶能够显著抑制 PA 引起的肝细胞凋亡(凋亡率由 ~26% 降至 ~4.6%)(图6D)。在细胞层面验证了该纳米酶可同时缓解脂肪堆积、清除 ROS、防止细胞死亡,三大功能协同作用,从而保持细胞膜完整性和细胞活力,展现出了优越的综合保护效果。
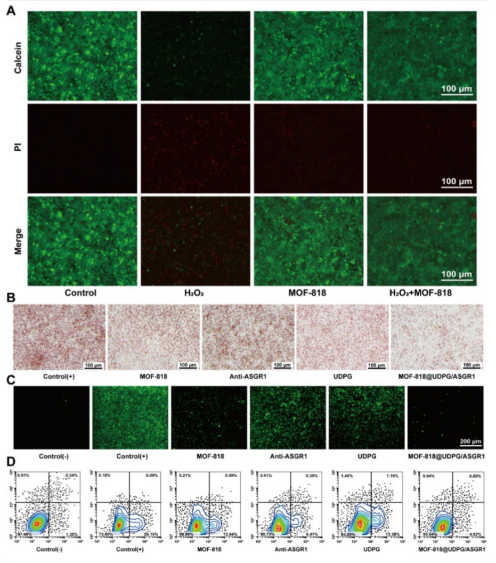
图6 MOF-818 @ UDPG / ASGR1的体外细胞研究
7、MOF-818 @ UDPG / ASGR1改善饮食诱导的肝脏脂肪变性的体内治疗效果
为了该纳米平台在体内的治疗潜力,使用特定的高脂饮食(HFD)诱导肝脏脂肪变性,建立了MASLD的小鼠模型。模型组给药后发现血清ALT/AST水平显著下降(图7A–B),总胆固醇(T-CHO)、甘油三酯(TG)水平也明显降低(图7C–D)。模型组的肝脏中2种关键抗氧化酶SOD和CAT的活性被显著抑制,表明其应对氧化应激的能力降低(图7E–F)。H&E和油红O染色显示给药组肝脏脂肪空泡大幅减少,炎症灶少见(图7G–H)。在动物模型中全面验证了该纳米酶的强效抗脂肪变性作用,且疗效依赖于 ASGR1 介导的靶向机制,体现了精准治疗的优势。
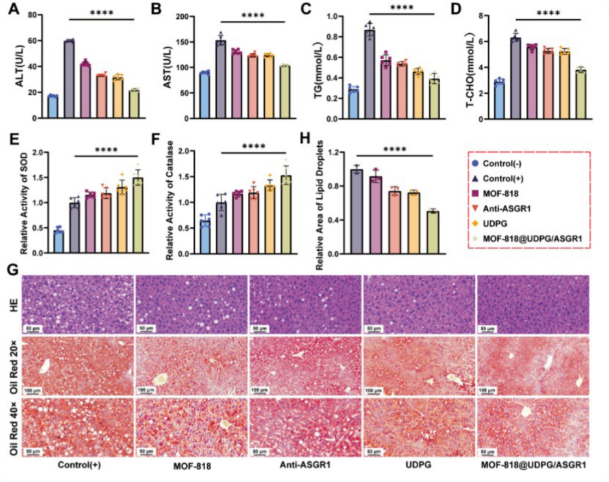
图7 MOF-818 @ UDPG / ASGR1改善饮食诱导的肝脏脂肪变性的体内治疗效果
8、阐明MOF818 @ UDPG / ASGR1协同抗脂肪变性作用的分子机制
为了阐明MOF - 818 @ UDPG / ASGR1改善肝脏脂肪变性的分子机制,对MASLD假治疗和MOF - 818 @ UDPG / ASGR1治疗小鼠的肝脏组织进行转录组测序( RNA-seq )。火山图和PCA 分析显示治疗组与模型组明显分离,表明基因表达发生全局性改变;GSEA 分析进一步显示:胆固醇稳态通路被激活(支持 LXRα 功能);IL-6/JAK/STAT3 等炎症通路被抑制;脂滴相关基因(Plin4, Cidec)、P450 酶(Cyp4a14)等致病因子下调(图8A-B)。Western Blot 证实该处理特异性增强BRCA1 / BARD1复合物,并激活其下游靶标LXR α(图8C-E),同时 SLC35F5 蛋白的上调支持了 UDPG 通路的激活,显著降低TNF - α、p - NF - κ B p65和IL – 6蛋白表达水平(图8F–K)。该部分综合表明:ASGR1 触发信号传导 + UDPG 抑制新生脂 + MOF 清除 ROS,三者协同发挥作用。
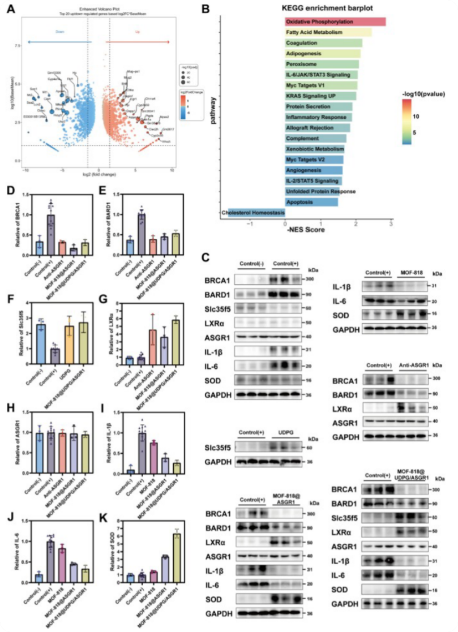
图8 阐明MOF818 @ UDPG / ASGR1协同抗脂肪变性作用的分子机制
三、研究结论
该研究成功构建了一种多功能纳米酶MOF-818@UDPG/ASGR1,通过协同调控双通道脂质代谢和清除活性氧(ROS),有效缓解肝脂肪变性。该纳米酶兼具ASGR1抗体介导的肝细胞靶向能力、UDPG抑制脂肪生成以及MOF-818核心的抗氧化酶活性,在细胞和动物模型中均显著减轻脂质积累、氧化应激和肝损伤。转录组分析进一步证实其通过激活LXRα促进脂质外排、抑制SREBP1c介导的脂肪合成,实现多靶点协同治疗效果。
四、总结与展望:多靶点治疗的未来与京房的使命
总之,这篇论文展示了一个从理性设计→精准合成→多维度表征→体内外药效验证→多组学深度机制挖掘的完整、高水平研究范例。MOF-818@UDPG/ASGR1的成功,代表了未来治疗复杂代谢疾病(如MASLD、糖尿病、动脉粥样硬化等)的一种趋势:即开发能够同时干预多个病理环节的智能集成化纳米平台。
对于我司而言,这项研究既是一个绝佳的学习案例,也凸显了我们所提供技术服务的前沿价值和必要性。我们不仅是数据的生产者,更是赋能创新发现的伙伴。 当越来越多的科研人员和医药企业投身于类似的多靶点、多功能纳米药物或生物制剂开发时,他们最终都需要回答一个核心问题:“它究竟是如何起作用的?”
回答这个问题,离不开:
京房生物,凭借在表观基因组学等高通量测序技术上深厚的专利积累、严格的质量控制和丰富的项目经验,致力于为每一位致力于解决生命科学难题、开发创新疗法的科研勇士,提供最可靠、最前沿的“分子洞察力”武器。让我们共同携手,解码生命奥秘,助力健康未来!
参考文献:
A multifunctional MOF-818-based nanozyme for synergistic therapy of hepatic steatosis via dual-channel lipid regulation and ROS scavenging