| 时间:2025-10-13 |
2025年发表于《Cell Rep》(IF=6.9)
一、研究背景
DDX3X属于DExD/H-box解旋酶家族,参与RNA代谢的多个方面,并在抗病毒先天免疫中发挥作用。DDX3X在多种癌症中经常发生突变,但其致癌或抑瘤功能仍存在争议。EB病毒(EBV)是一种致癌病毒,与多种癌症和炎症性疾病相关,其裂解基因在肿瘤发生中可能起重要作用。R-loop是一种三链核酸结构,其异常积累可导致基因组不稳定,与肿瘤发生密切相关。本研究旨在探讨DDX3X突变与EBV感染之间的功能相互作用,以及它们如何共同诱导R环依赖性肿瘤发生。
二、研究结果
1、DDX3X突变的泛癌分析及其生物学和结构改变
DDX3X突变在淋巴恶性肿瘤(如Burkitt淋巴瘤、NKTCL和DLBCL)中显著富集,这些癌症类型与EBV感染密切相关(图1A)。DDX3X突变主要集中在两个高度保守的D1和D2结构域(图1B)。GO富集分析表明DDX3X突变导致与免疫反应、病毒反应和RNA解旋酶功能相关的基因表达发生变化(图1C-D)。Western Blot和ELISA实验表明STING和IRF-7的表达和磷酸化水平低于DDX3XWT(图1E-F)。

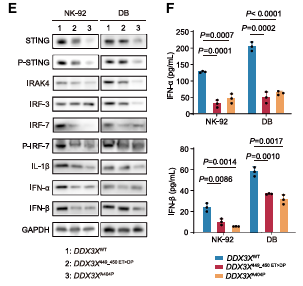
图1 DDX3X通过STING/IRF-7介导的IFN-α/β激活调节抗病毒先天免疫
2、DDX3X突变诱导EBV裂解基因BNLF2b过表达
DDX3X突变细胞中的EBV病毒拷贝数显着更高(图1G)。只有 BNLF2b 表达在 DDX3X 突变时显着上调,而其他EBV基因的表达水平保持不变(图1H )。DDX3X的突变可能影响细胞对外源性EBV感染的反应,导致BNLF2b基因表达的上调(图1I)。在外源性EBV感染时,STING抑制剂C-176使BNLF2b表达水平进一步增强,而IRF-7激活剂CL075可挽救这一增强(图1J)。DDX3X发生突变时,观察到DDX3X蛋白BNLF2b RNA之间存在显著的共定位现象(图1K)。DDX3X中的449_450ET>DP或A404P型突变会减弱其与dsRNA的结合能力(图1L)。

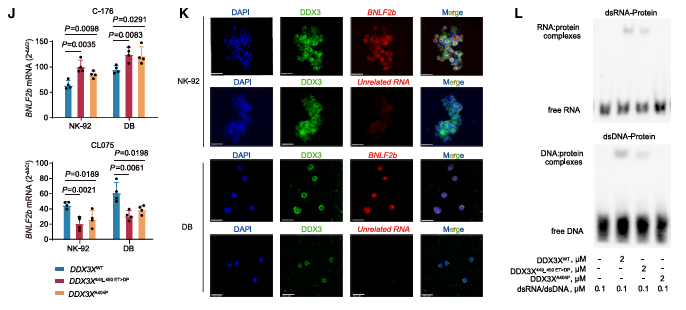
图1 DDX3X通过STING/IRF-7介导的IFN-α/β激活调节抗病毒先天免疫
3、DDX3X突变会损害RNA结合亲和力
DDX3X蛋白的A404P突变破坏氢键、改变ATP结合残基位置,导致ATP结合/水解条件不利,使RNA与蛋白相互作用失效(图2A-B)。而449_450ET>DP突变增大了蛋白整体结构波动(图2C),其突变体呈现显性“扭曲”构象,D2结构域顺时针旋转30°,与WT的“原位”构象形成对比(图2D)。D2相对于D1移位更大,破坏了氢键,并导致D1/D2界面面积显著减少,并且它的晶体结构与RNA结合结构的差异最大(图2E-G)。总之,DDX3X449_450ET>DP突变具有最不利于RNA结合的显性构象,成为代表性的 DDX3X 突变。
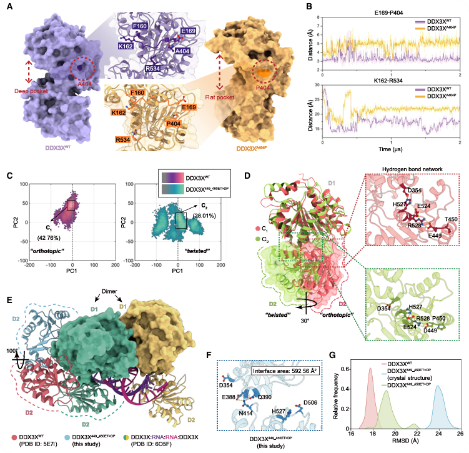
图2 DDX3X的结构表征A404P型和DDX3X449_450ET>DP
4、转基因小鼠模型概括了R环依赖性致癌过程
通过CRISPR-Cas和腺相关病毒(AAV)介导,成功构建了Ddx3xfl/+(Y), pAAV-BNLF2b转基因小鼠模型(图3A)。该小鼠出现脾肿大现象(图3B)。IF/FISH实验证实DDX3X和BNLF2b在小鼠脾脏中共定位(图3C)。染色结果显示,该小鼠的脾脏、肝脏和骨髓中有异常细胞增殖(图3D-E)。G带核型分析显示,Ddx3xfl/+(Y)小鼠的骨髓染色体存在非整倍体现象,引入pAAV-BNLF2后增强。流式细胞术分析发现,Ddx3xfl/+(Y)小鼠中CD3−CD19−NK1.1+淋巴细胞簇显著增加,而T细胞、B细胞的比例不变(图3F-G)。
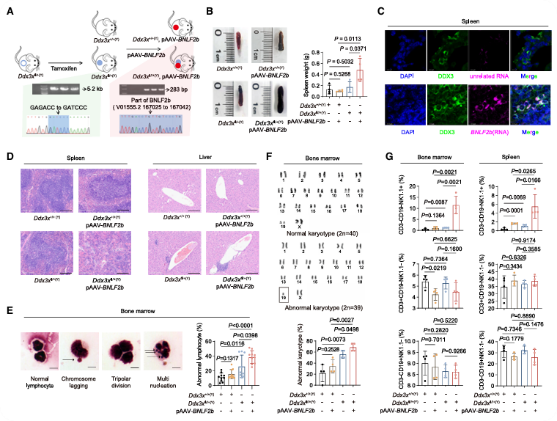
图3 DDX3xfl/+(Y),pAAV-BNLF2b 转基因小鼠模型概括了R环介导的致癌过程
从Ddx3xfl/+, pAAV-BNLF2b小鼠的骨髓和脾脏中分离出的多种细胞用于研究恶性表型(图4A)。流式细胞术显示,CD3−CD19−NK1.1+淋巴细胞中BNLF2b表达显著升高,Ki67+细胞比例增加,同时,大量细胞共表达Ki67和BNLF2b(图4B-C)。Ddx3xfl/+, pAAV-BNLF2b小鼠的CD3−CD19−NK1.1+淋巴细胞具有更强的多层生长和细胞转化能力(图4D)。移植了该细胞的受体小鼠增殖能力更强,其脾脏和肝脏细胞浸润更明显(图4E-G)。综上所述,DDX3X突变在EBV裂解基因 BNLF2b 的帮助下,突变表现出致瘤潜力。
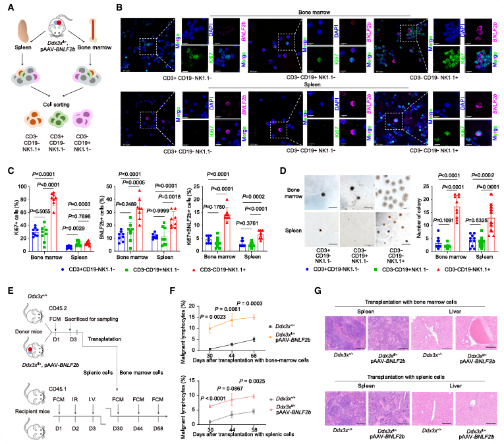
图4 CD3−/CD19−/NK1.1+淋巴细胞的恶性表型
5、DDX3X突变改变R环平衡和基因组不稳定性
介绍了NK-92细胞中DRIPc-seq实验,发现表达外源BNLF2b的DDX3XMUT细胞出现大规模的R环诱导,受影响区域与有丝分裂细胞周期、RNA代谢和免疫反应相关,且相关基因在 DDX3X 突变患者中显着失调(图5A-D)。与野生型相比,DDX3XMUT细胞在BNLF2b过表达时显示出更广泛的R环积累,可被RNase H处理消除,证实为真正的R环(图5E)。STING抑制剂增加R环的积累,而IRF-7激活剂相反(图5F)。DDX3X突变体与RNA-DNA和DNA-RNA杂交体的结合力降低(图5G)。DDX3XMUT细胞中,BNLF2b的外源表达使染色体异常核型显著增加,而在野生型中无此现象(图5H-I)。总之,DDX3X 突变先天免疫受损、核苷酸结合亲和力降低,增强 BNLF2b 过表达和异常R环积累,驱动了基因组不稳定性介导的癌症发展。
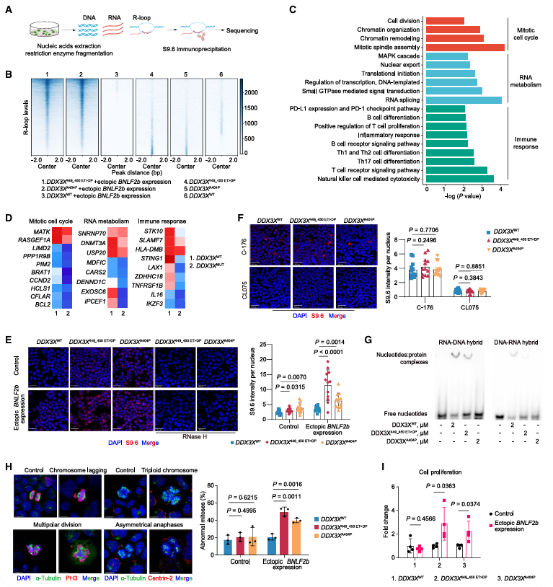
图5 DDX3X突变和BNLF2b合作诱导R环积累
6、DNA损伤剂触发DDX3XmutBNLF2b+肿瘤的合成致死性
依托泊苷(etoposide),一种抗癌药物,它对DDX3X突变细胞更有效,在EBV感染或BNLF2b过表达的细胞中显示出更高的敏感性。该药物能增强DNA双链断裂标志物γ-H2AX的表达,并诱导caspase-3发生裂解(图6A-B)。值得注意的是,去除R环可显著增加对依托泊苷的耐药性(图6C)。依托泊苷处理的受体小鼠中观察到CD45.2+CD3−CD19−NK1.1+细胞的增殖受到显著抑制,同时γ-H2AX、R环及裂解的caspase-3阳性细胞数量有所增加(图6D-E)。此外,DDX3X突变患者在接受依托泊苷治疗后,生存率显著提高(图6G)。作为一种作用机制(图6H),DDX3X突变抑制了EBV裂解基因BNLF2b的抗病毒免疫并增强了过表达,这有助于DDX3X突变诱导异常的R环积累和相关的基因组不稳定性,以R环依赖性方式赋予肿瘤发生。
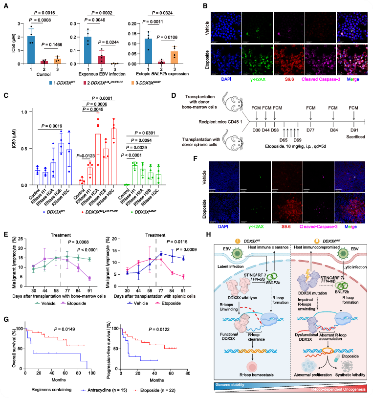
图6 依托泊苷诱导具有治疗潜力的合成致死性 DDX3XmutBNLF2b肿瘤+
三、研究结论
本研究发现DDX3X突变与Epstein-Barr病毒(EBV)合作,通过诱导R环依赖性肿瘤发生机制促进癌症发展。DDX3X突变损害先天免疫,促进EBV裂解基因BNLF2b表达,进而导致R环积累、基因组不稳定和异常增殖。此外,DNA损伤剂依托泊苷可增强R环与γ-H2AX的共定位,触发DDX3X突变肿瘤的合成致死性,为治疗相关癌症提供了潜在的新靶点。
参考文献:
DDX3X mutation and Epstein-Barr virus cooperate to induce R-loop-dependent oncogenesis.