| 时间:2025-02-21 |
2024年发表于《Advanced science》(IF=14.3)
一、研究背景
氟尿嘧啶(5-FU)是晚期胃癌(GC)化疗的基础药物,但有部分患者对基于5-FU的化疗不敏感。探索5-FU耐药机制并有效干预可能为解决耐药性提供潜在方案。已有研究发现,SEs可促进三阴性乳腺癌的化疗耐药,SEs驱动转录因子(TFs)形成核心转录调控回路(CRCs),而很少有研究探讨CRCs和主TF对GC化疗敏感性的影响。因此本研究对5-FU敏感和耐药的GC细胞的SEs和CRCs进行了表征,发现抑制剂JQ1和抑制剂C297可以提高GC中5-FU的敏感性。这些发现为胃癌患者提供了一种潜在的药物联合方案。
二、研究小结
采用ChIP-seq和H3K27ac ROSE算法鉴定了SEs和超级增强子相关基因(SRGs)(图1B、C)。SRGs的KEGG和GO富集分析显示,两种细胞类型的SRGs在胃癌、结直肠癌和粘附连接等癌症相关通路中均富集。通过DEGs、SRG和自调节功能的TF,计算确定了最可能的CRCs(图1I、J),5-FU耐药的决定因素被缩小到CRCs中列出的TF。
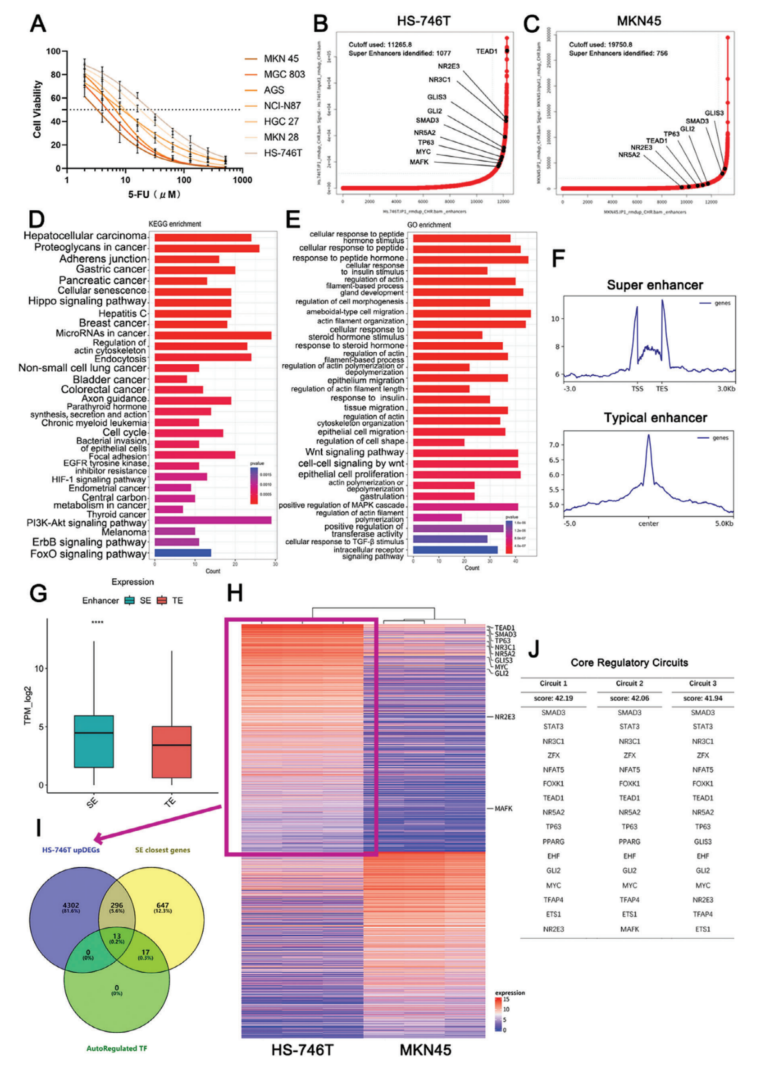
图1 5-FU耐药GC细胞的超级增强子景观和核心转录调控回路
NR3C1敲低对整个CRCs组的抑制最为显著,且使GC对5-FU更加敏感。因此,选择NR3C1进行后续研究。
对GC细胞进行了NR3C1的CUT&Tag测定(图2A)。结合H3K27ac ChIP-seq结果表明,NR3C1更可能在GC细胞的SEs区高度富集(图2B)。基于H3K27ac ChIP-seq和RNA-seq描述了SEs景观(图2C-E)。NR3C1敲低组SEs区域数量(图2C,D)、SEs和TEs的H3K27ac峰值均显著降低(图2F、G)。这表明NR3C1显著下调抑制H3K27ac信号,改变GC的SEs景观。
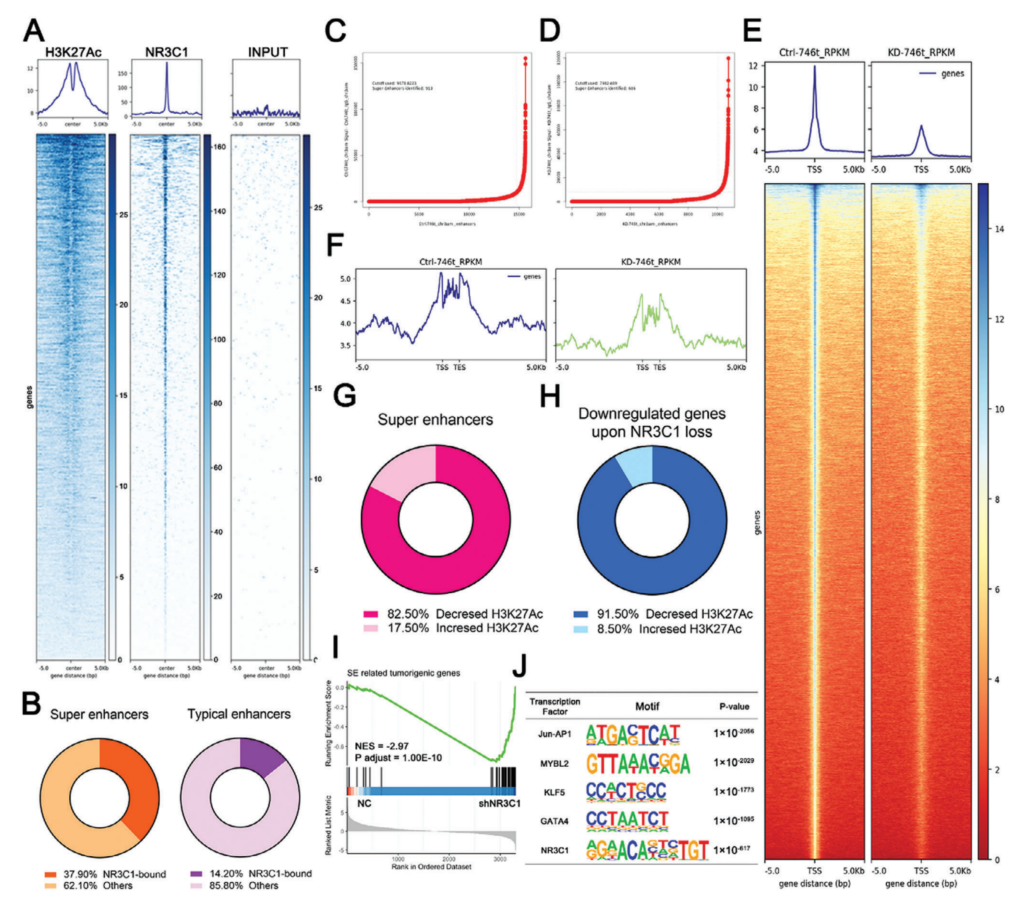
图2 NR3C1敲低诱导GC细胞增强子重构
在5-FU耐药细胞中,通路富集分析表明SRGs激活了一系列致癌信号通路。NR3C1响应外部刺激并影响转录调控以维持细胞增殖。将NR3C1敲低后发现:其对SRGs、NR3C1结合基因集和NR3C1敲低组的下调DEGs三者交集中5-FU相关基因的促进作用丧失。JQ1和5-FU可以发挥协同作用。
异种移植(PDX)模型实验结果显示,5-FU+JQ1和5-FU+C297均能显著抑制肿瘤生长;两者联合使用有更强的抑制作用。该结果展现了5-FU+JQ1和5-FU+C297作为治疗5-FU耐药肿瘤的潜在药物组合的临床转化价值。
参考文献:
Super-enhancer Activates Master Transcription Factor NR3C1 Expression and Promotes 5-FU Resistance in Gastric Cancer.[J]Advanced science, 2024.