| 时间:2024-12-20 |
2024年发表于《Genome Biol》(IF=10.8)
一、研究背景
转座元件(TEs)在哺乳动物基因组中占据重要地位,其中短散在核元件(SINEs)在神经发育中发挥关键作用。SINEs本身不编码蛋白质,但可以在转录功能RNA或充当增强子,影响神经发生、神经元成熟和神经网络建立等过程。表观遗传调控,如DNA甲基化和组蛋白修饰,在神经发育中起着关键作用,而H3K9me3和CTCF等表观遗传标记在TEs调控中发挥重要作用。SETDB1是一种组蛋白甲基转移酶,靶向H3K9me3,在TEs调控中发挥关键作用,尤其是抑制LTR类TEs,包括ERVs。然而,SETDB1在SINEs调控中的作用尚不清楚,本研究旨在阐明其调控机制。
二、研究结果
1、小鼠NPC中敲除 SETDB1 SINE_B2元件上的染色质可及性增加
与野生型神经祖细胞相比, SETDB1敲除小鼠神经祖细胞(NPC)中,超过65%的染色质可及性增加峰位于TEs,其中近一半与SINE_B2元件相关(图1A-B)。SINE_B2元件表现出较高的染色质可及性,尤其在基因丰富区域,提示其潜在的调控功能(图1C-D)。 SETDB1敲除组中,SINE_B2元件的染色质可及性显著增加,且主要分布在基因丰富区域(图1E-G)。染色质可及性增加和H3K9me3减少的SINE_B2元件富含CTCF结合位点(图1H)。这些发现表明,NPC定SINE_B2元件群的染色质可及性受SETDB1控制。
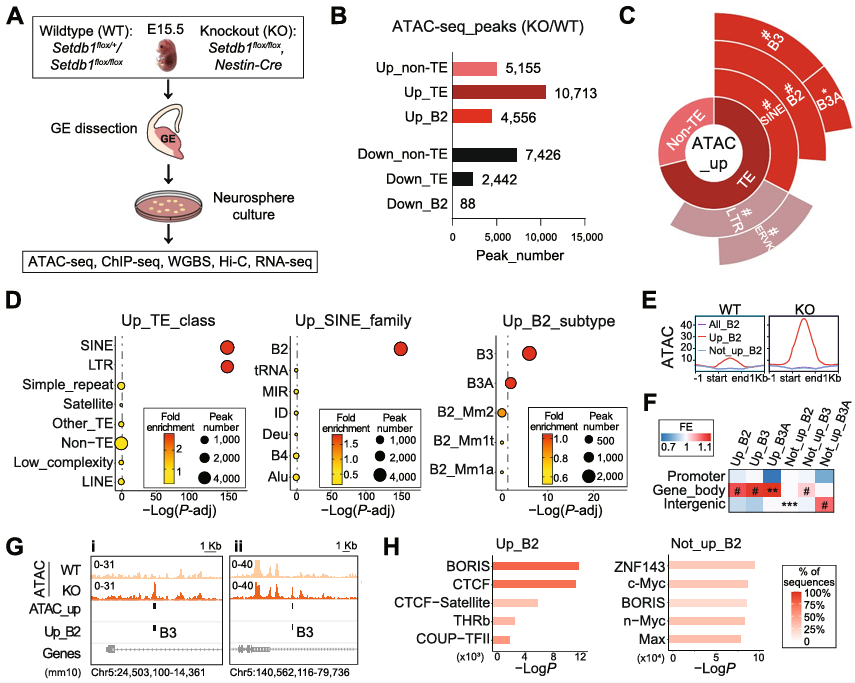
图1 小鼠神经前体细胞SETDB1敲除后SINE_B2元件上的染色质可及性增加
2、NPC中敲除 SETDB1 H3K9me3在SINE_B2上表达降低
H3K9me3 ChIP-seq结果显示,野生型和SETDB1敲除组之间存在显著差异,并且SETDB1敲除组中,H3K9me3下调峰的数量显著增加,且这些峰主要位于基因区和TEs(图2A-B)。H3K9me3和ATAC-seq信号在SINE_B2元件上的分布情况结果表明,在野生型中,H3K9me3信号主要分布在染色质可及性增加的SINE_B2元件上,而在SETDB1敲除组中,H3K9me3信号几乎消失,并且H3K9me3下调峰的染色质可及性显著增加(图2C-G)。这些发现表明SETDB1敲除NPC中H3K9me3信号的丢失可能有助于在SINE_B2元件上观察到的染色质可及性增加。
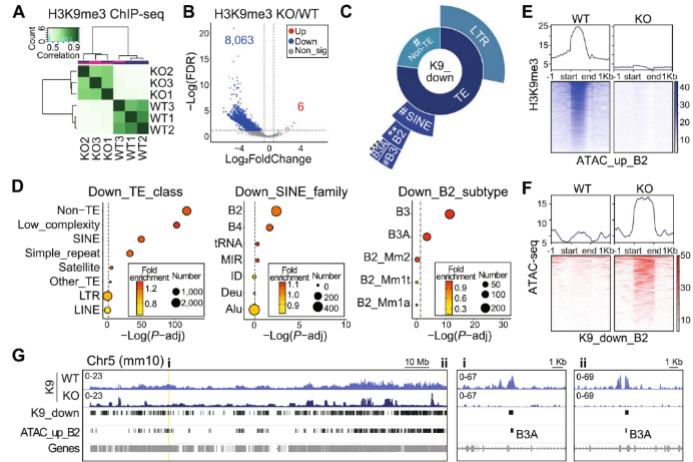
图2 NPC中SETDB1敲除后H3K9me3在SINE_B2上的减少
3、NPC中敲除 SETDB1会导致DNA甲基化发生改变
SETDB1敲除组中,差异甲基化区域(DMR)的数量显著增加(图3A)。相比于野生型,SETDB1敲除组的DNA甲基化水平总体上在TEs区域有所降低,在SINEs区域降低幅度更大,在非TEs区域略有升高(图3B),SINE_B2区域的DNA甲基化水平降低的区域(DMR_hypo)显著富集,LTR区域的DNA甲基化水平有所降低(图3C-D)。SETDB1敲除组中,大量DMR和ATAC-seq峰位于染色质可及性增加的区域,且H3K9me3信号几乎消失(图3E-F)。在野生型中,H3K9me3信号和DNA甲基化水平在染色质可及性增加的SINE_B2元件上较低,而在SETDB1敲除组中,DNA甲基化水平进一步降低(图3G)。这些研究表明DNA甲基化也参与了SETDB1介导的NPC中B2元件的抑制。
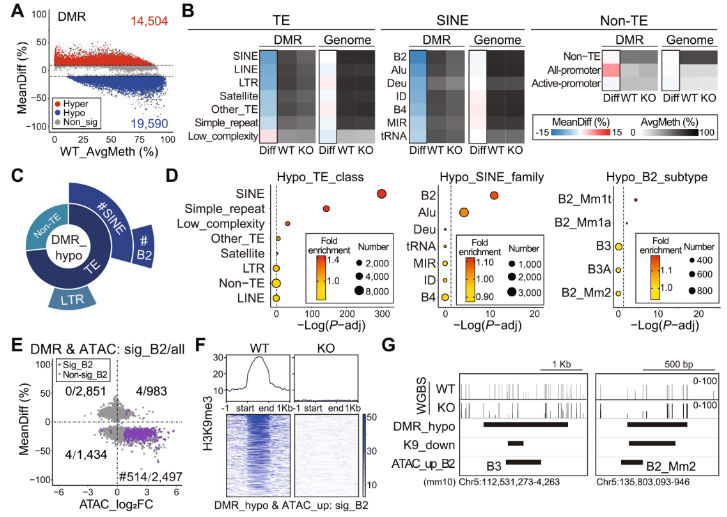
图3 NPC中 敲除 STEBD1后DNA甲基化的改变
4、NPC 中 敲除SETDB1导致CTCF与SINE_B2结合的增加
SETDB1敲除导致CTCF结合显著增加,表现为CTCF结合峰数量增加,信号增强(图4A)。CTCF结合峰主要富集在SINE_B2元件上,尤其是B3A和B3亚型,并且CTCF结合峰与ATAC-seq高峰存在显著重叠,表明CTCF结合与染色质开放性相关(图4B-C)。敲除SETDB1导致CTCF结合峰上的H3K9me3信号降低和DNA甲基化水平降低(图4D-H)。CTCF结合峰主要位于非启动子区域,表明CTCF可能通过染色质相互作用间接调控基因表达(图4I)。这些发现强调了NPC中敲除SETDB1后CTCF对SINE_B2元件结合增加的特异性。
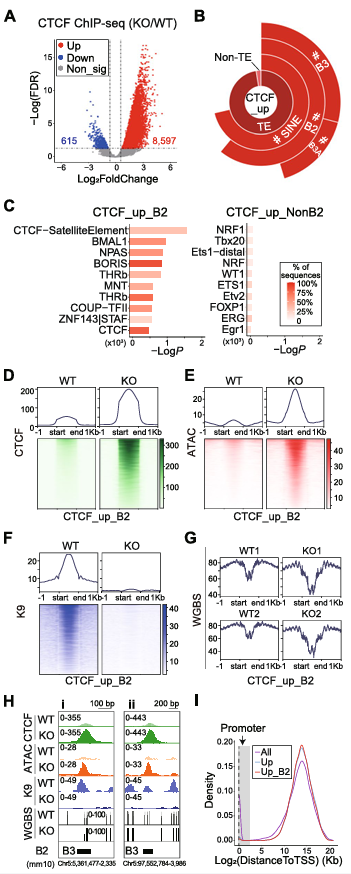
图4 NPC中敲除SETDB1后CTCF结合在SINE_B2上的增加
5、敲除SETDB1导致CTCF结合增加,SINE_B2上染色质环重组
野生型和SETDB1敲除小鼠NPC中拓扑关联结构域(TAD)的宽度分布以及TAD边界的绝缘分数热图和轮廓图均没有显著差异(图5A-B)。SETDB1敲除组的染色质环接触强度显著降低,导致染色质环之间连接减弱(图5C)。SETDB1敲除小鼠NPC中NLA的数量明显增加,LLA的数量明显减少,ULA的数量变化不大,并且NLA上的CTCF结合信号明显和重叠数量都增加,而LLA和ULA上的CTCF结合信号没有显著变化(图5D-F)。CTCF结合位点主要以convergent (><) 方式锚定在染色质环锚点上,而NLA主要与CTCF_up_B2相重叠(图5G-I)。这表明,尽管增加的CTCF结合不会干扰TAD的构象,但由于NPC中SETDB1的丢失,它可能有助于染色质环的重组。
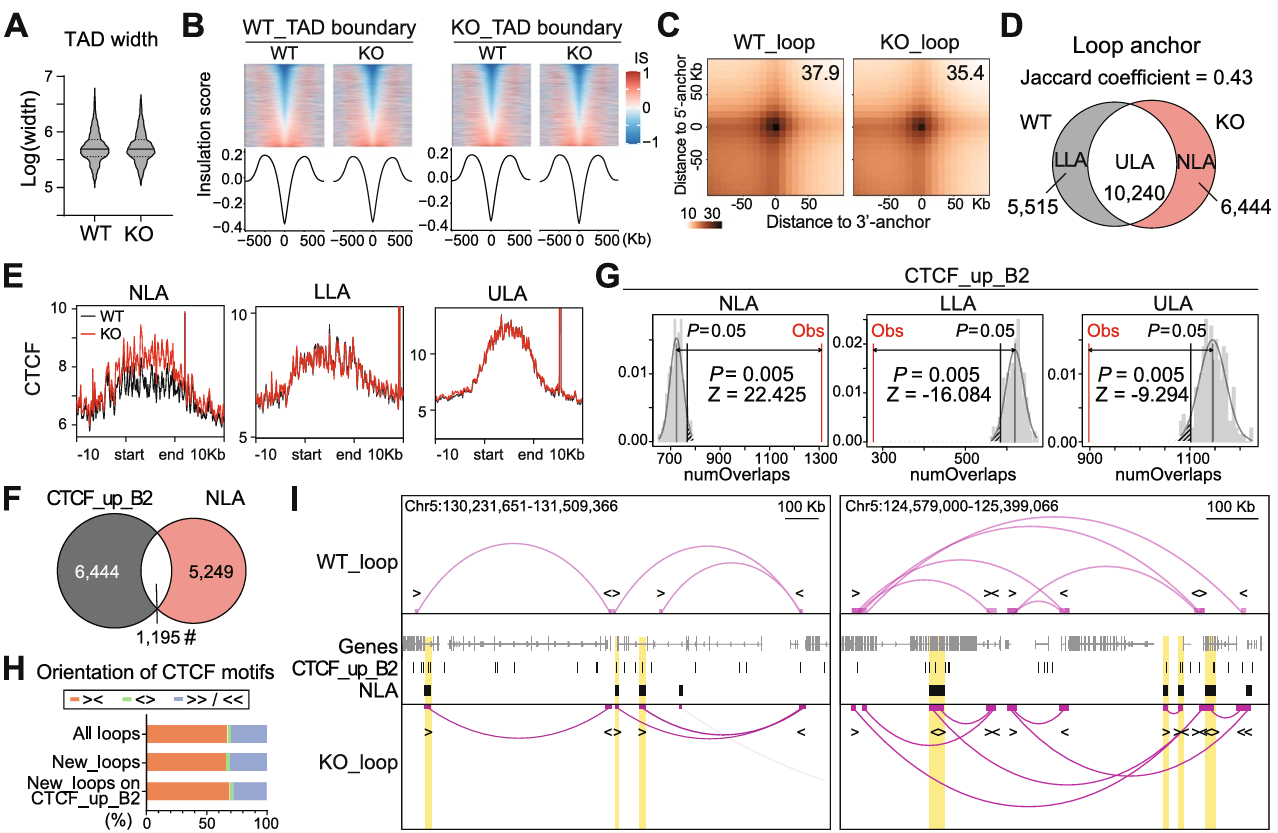
图5 敲除SETDB1后CTCF结合增加,SINE_B2上染色质环重组
6、敲除SETDB1后染色质环重组与差异基因表达
敲除SETDB1,形成了新的染色质环的锚定点,与DEG启动子的重叠程度显著高于丢失环和未改变环,新环锚定点上的DEG表达水平较高,且在聚类分析中呈现出明显的特征(图6A-B)。SETDB1敲除后表现出更高的染色质可及性、H3K9me3水平降低、DNA甲基化水平降低和CTCF结合增加(图6C)。这些DEG富集于与有丝分裂染色体分离相关的网络和通路(图6D),而且其启动子区域富集了CHR(细胞周期基因启动子的同源区域),以及JunD、NRF1和Sp转录因子的结合位点(图6E-F)。SETDB1敲除后,Cenpe基因的启动子与CTCF_up_B2元素重叠,CTCF结合增加(图6G)。这些数据表明,由于CTCF与B2元件的过度结合,KO中新形成的染色质环导致SETDB1敲除NPC中有丝分裂基因的失调。
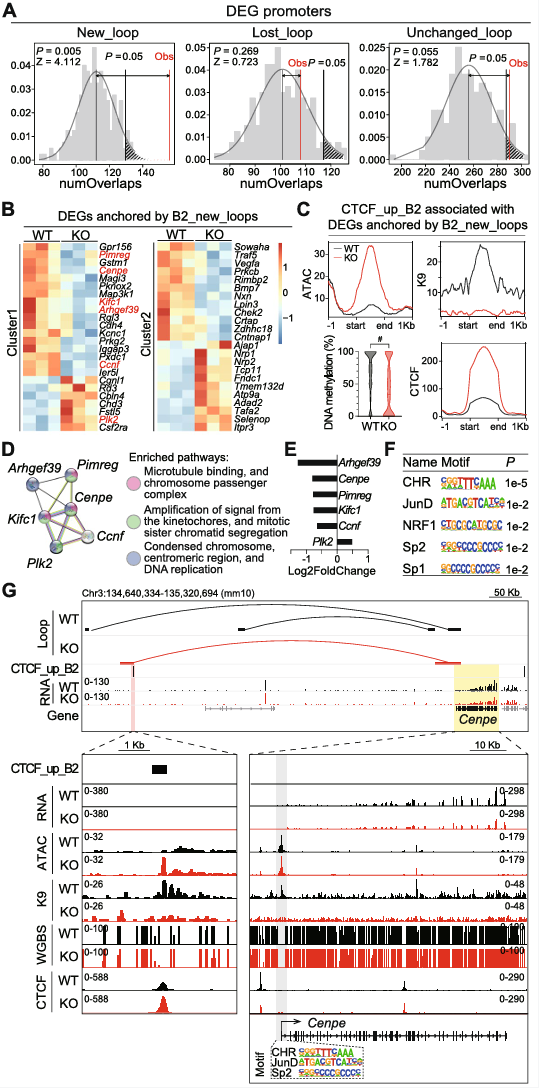
图6 与SETDB1敲除后环重组相关的差异基因表达
7、敲除SETDB1导致NPC增殖受损
SETDB1敲除组的神经球直径显著小于野生型组,表明SETDB1敲除组神经祖细胞的增殖能力下降(图7A)。SETDB1敲除组的G2/M期细胞比例显著降低,而G1期细胞比例呈现上升趋势,表明SETDB1敲除组细胞可能进入G1期的时间延长,或从G1期到S期的转变减慢(图7B)。ETDB1敲除组的BrdU标记细胞和磷酸化组蛋白H3标记细胞数量也显著减少(图7C-D)。总之,从体外和体内研究中获得的结果表明,由于 SETDB1 的缺失,导致神经祖细胞增殖能力下降,细胞周期变慢,有丝分裂减少。

图7 敲除SETDB1后NPC增殖受损
三、研究结论
SETDB1通过H3K9me3和DNA甲基化限制小鼠神经前体细胞定SINE_B2元件的染色质可及性。SETDB1基因敲除导致这些元件上的CTCF结合增加,会促进染色质环重组,这种重组会影响基因表达,特别是与有丝分裂相关的基因,最终破坏神经前体细胞的增殖。总之,SINE_B2元件在神经发育中的表观遗传调控和细胞增殖中起着重要作用。
参考文献:
SETDB1 regulates short interspersed nuclear elements and chromatin loop organization in mouse neural precursor cells. Genome Biol. 2024 Jul 3