| 时间:2024-12-13 |
2024年发表于《Nature》(IF=50.5)
一、研究背景
细胞内氨基酸的丰度通过一个复杂的机制来精确地感知,以调节各种细胞信号通路和功能。细胞内氨基酸水平不足可能会阻止tRNA分子从GCN2释放,从而激活GCN2-ATF4通路,这是一种间接感知氨基酸水平的机制。此外,一些氨基酸的细胞内水平可以通过mTORC1的机制靶点直接与特定的传感器结合来感知。目前尚不清楚氨基酸是否也能以不依赖tRNA和mTORC1的方式直接被感知。缬氨酸作为一种必需的支链氨基酸,在蛋白质合成、神经行为、造血和白血病进展中起关键作用。然而,细胞缬氨酸丰度对后续细胞功能的感知机制仍未明确。
二、研究结果
1、缬氨酸与HDAC6的SE14结构域结合
为了确定缬氨酸的潜在感应器,将生物素与缬氨酸的氨基结合,并亲和纯化了潜在的缬氨酸结合蛋白。下拉实验质谱结果显示HDAC6与缬氨酸结合最强(图1a),平衡结合实验也证实了两者可结合(图1b、c)。生物素下拉试验说明HDAC6与缬氨酸之间是特异性结合(图1d)。为研究了缬氨酸与HDAC6结合的结构特征,发现SE14重复结构域的缺失使HDAC6与缬氨酸的结合终止(图1f)。SE14重复结构域中具有保守序列的SE14-4肽(残基960-974)与缬氨酸的结合亲和力最高(图1h)。HDAC6的SE14保守位点突变体(SE-Mut HDAC6)无法与缬氨酸结合。综上可知,SE14重复结构域在缬氨酸与HDAC6结合中有重要作用。
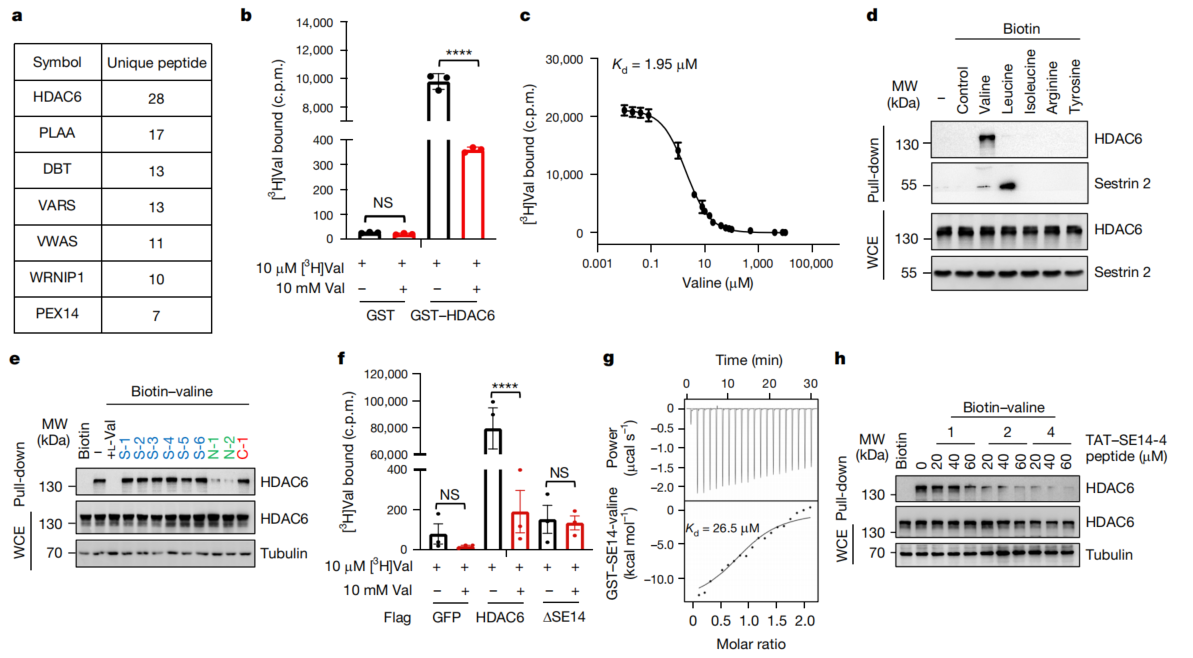
图1 缬氨酸直接与人类HDAC6的SE14重复结构域结合
2、缬氨酸决定了HDAC6的定位
HDAC6作为一种乙酰化酶,主要定位于细胞质中,部分存在于细胞核中。为研究了缬氨酸结合是否影响HDAC6的亚细胞定位。正常培养的HCT116细胞中,HDAC6主要在细胞质中,而缬氨酸的缺失会诱导大部分HDAC6的核定位(图2a);补充缬氨酸可恢复HDAC6的细胞质定位(图2b-d)。通过基因敲除或使用JPH203来阻断SLC7A5,抑制细胞外缬氨酸转运到细胞质中,均促进了HDAC6的核易位。HDAC6核易位与其结合的缬氨酸有关,并受到细胞内缬氨酸水平的调节。突变体SE-Mut HDAC6定位于细胞核,与缬氨酸水平无关(图2g)。在缬氨酸剥夺诱导HDAC6核易位的机制研究中发现,NLS的缺失抑制了由缬氨酸剥夺引起的HDAC6核易位。综上可知,表明缬氨酸通过SE14重复结构域与HDAC6结合是细胞质定位所必需的。
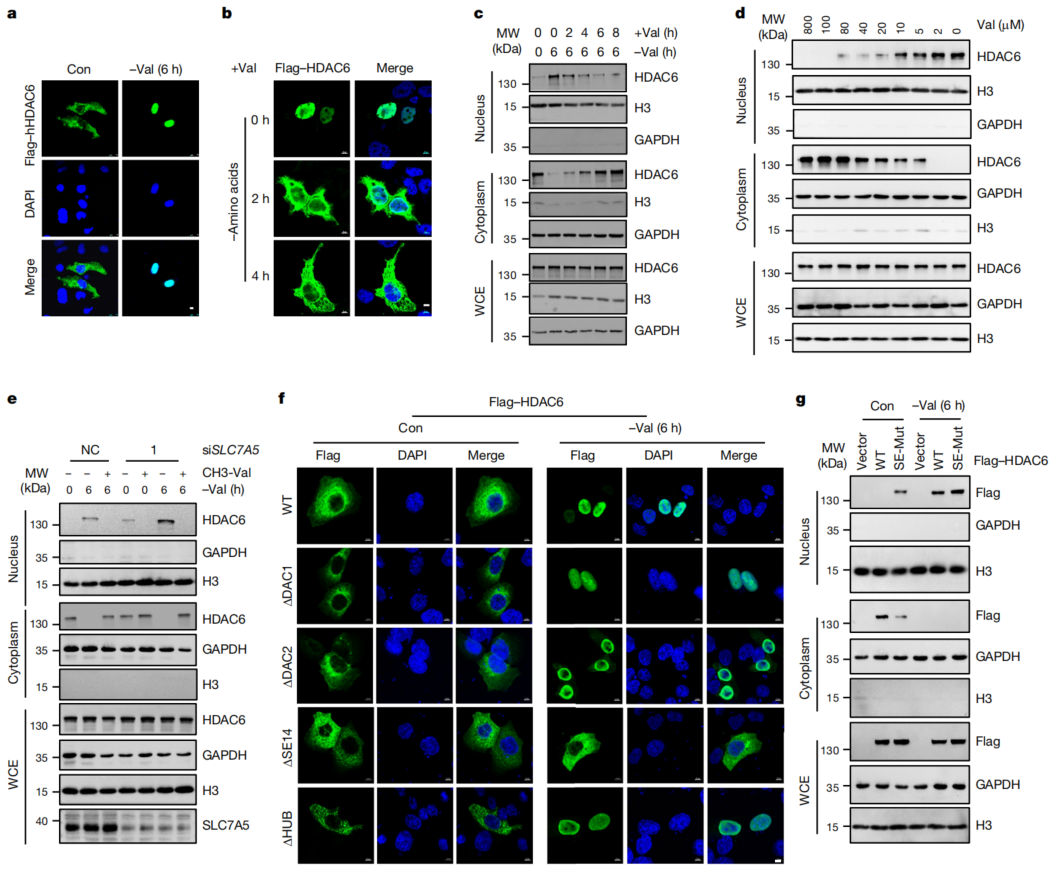
图2 细胞内缬氨酸丰度决定了HDAC6的亚细胞定位
3、灵长类动物特有的缬氨酸与HDAC6的结合
由于SE14重复结构域仅存在于灵长类动物的HDAC6蛋白中,因此研究了缬氨酸是否以物种特异性的方式与HDAC6结合。小鼠HDAC6由于没有SE14重复结构域,无法结合缬氨酸,并且小鼠HDAC6的亚细胞定位不受缬氨酸剥夺的影响。人SE14与小鼠HDAC6嵌合体恢复了其与缬氨酸的结合。因此,通过缬氨酸结合调控HDAC6亚细胞定位需要特异性SE14重复结构域。
4、核HDAC6促进TET2的活性
为了研究缬氨酸剥夺诱导的HDAC6核易位的生物学功能,检测了以缬氨酸依赖方式特异性结合HDAC6的核蛋白。SILAC和MS鉴定出356个蛋白在缬氨酸剥夺后与HDAC6的结合增强。其中核蛋白TET2与HDAC6排序靠前,其是一种DNA双加氧酶,可将5mC转化为5hmC、5fC和5caC。Co-IP也证实了两者的细胞内互作。缬氨酸剥夺以依赖HDAC6的方式显著增加5hmC的细胞水平(图3b)。以上结果表明缬氨酸剥夺可能以依赖HDAC6的方式促进TET2活性诱导DNA去甲基化。
由于TET2可能与DNA结合促进DNA去甲基化,通过ChIP-seq检测了缬氨酸剥夺诱导的TET2的结合位点。一部分区域在缬氨酸剥夺后TET2的结合显著增强(图3e)。这些数据表明缬氨酸剥夺诱导TET2的染色质结合,这与DNA去甲基化和5hmC、5fC和5caC的产生有关。HDAC6的去乙酰化酶活性对于其对TET2去乙酰化和活性的影响至关重要(图3h、i)。
TET2在三个保守赖氨酸残基(K1472、K1473和K1478)上发生乙酰化,赖氨酸转精氨酸(KR)突变增加了TET2的催化活性。因此,用TET2-CD转导细胞。缬氨酸剥夺以依赖HDAC6的方式增强了野生型TET2-CD的活性,而3KR突变体不依赖于缬氨酸剥夺或HDAC6缺失而增加了5hmC的水平(图3j、k)。此外,患者来源的催化失活突变体(H1881Q和R1896S)也支持了这一结果(图31、m)。以上结果表明,核HDAC6在缬氨酸剥夺后通过使TET2去乙酰化来促进TET2活性。
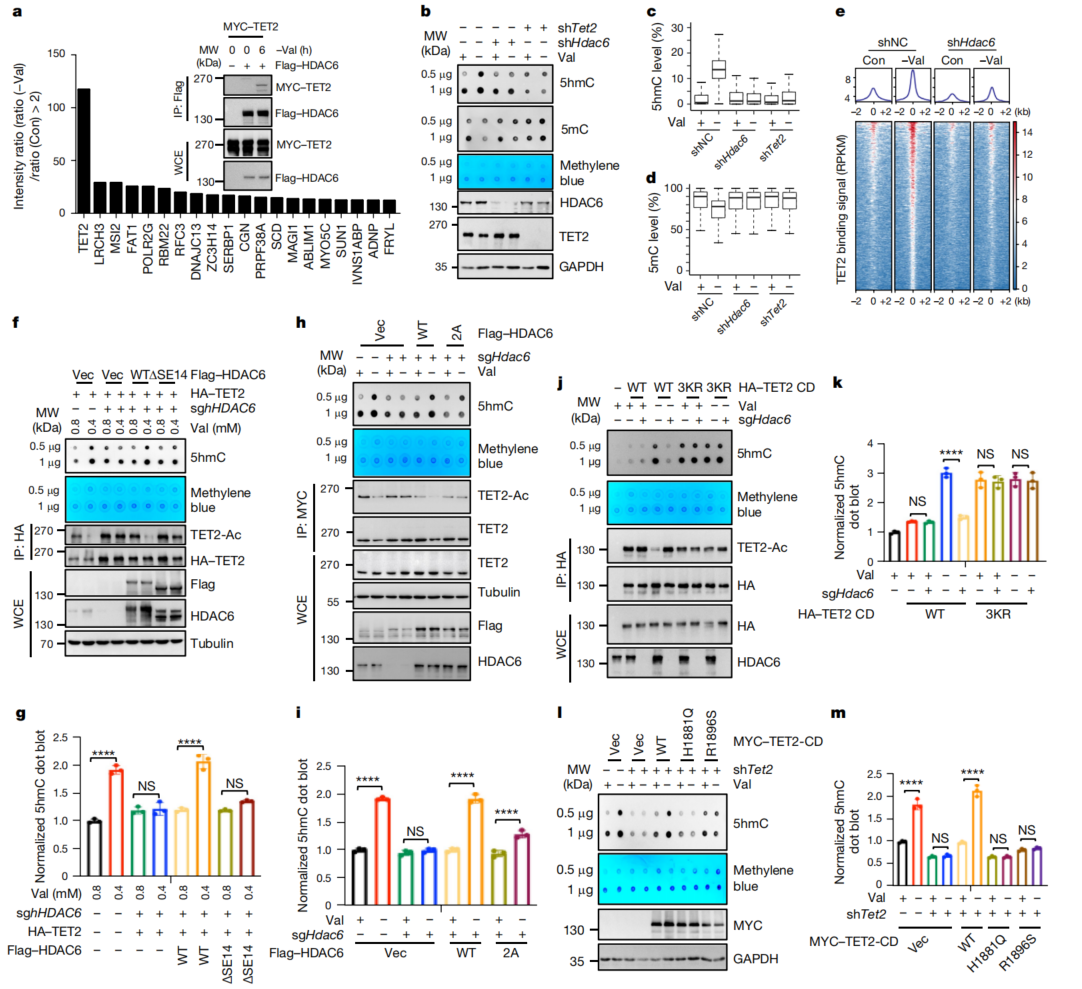
图3 核HDAC6促进TET2依赖的活性DNA去甲基化
5、VR通过HDAC6-TET2-TDG促进DNA损伤
已有研究表明TET2活性在DNA损伤中起着不同的作用。因此,研究了缬氨酸限制(VR)是否通过HDAC6-TET2轴促进DNA损伤。TET2或HDAC6的缺失阻断了缬氨酸剥夺引起的DNA损伤(图4a-c)。TET2介导的DNA损伤主要依赖于TDG驱动的单链DNA断裂(SSBs)的形成,通过UPLC-MS/MS和dot blot检测,缬氨酸剥夺和TDG敲低都上调了5fC和5caC水平。证实了TET2-TDG轴在缬氨酸剥夺诱导的DNA损伤中的关键作用。通过研究SSBs与5hmC和5fC位点在缬氨酸剥夺特异性增强TET2结合区域的共定位,发现这些DNA损伤位点主要位于增强子中(图4h)。缬氨酸剥夺增强了TET2活性,这反过来促进了活性DNA去甲基化,导致SSBs和双链DNA断裂。
为了进一步确认HDAC6核定位在介导缬氨酸剥夺诱导的DNA损伤中的具体作用,构建了一个核定位的HDAC6(nHDAC6)。nHDAC6以TET2依赖的方式增强DNA羟甲基化并诱导DNA损伤。ChIP-seq进一步证实了HDAC6基因敲除HCT116细胞中,TET2基因的在nHDAC6组增强的基因组分布。这些数据进一步说明了HDAC6核定位在缬氨酸剥夺诱导的DNA羟甲基化和相关DNA损伤中的重要作用。
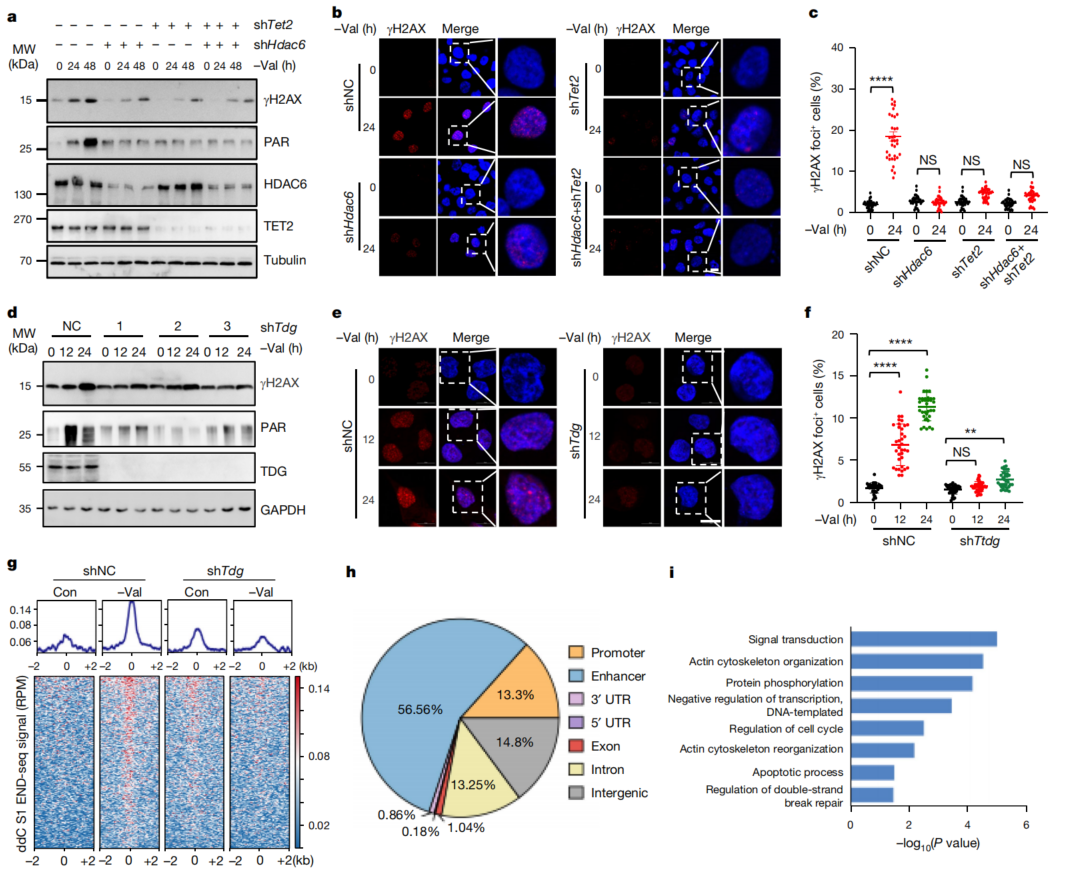
图4 缬氨酸的剥夺促进了DNA损伤反应HDAC6-TET2轴
6、膳食VR抑制癌症进展
持续性DNA损伤可通过促进程序性细胞死亡、DNA复制和抗肿瘤免疫来抑制肿瘤进展。鉴于缬氨酸剥夺会促进DNA损伤,研究了VR是否可以作为癌症的潜在治疗方案。缬氨酸剥夺以依赖HDAC6的方式减少癌球的数量和大小。在缬氨酸缺乏条件下,SE14敲入MEF的增殖速度比野生型细胞慢得多。这一结果支持了SE14结构域在协调HDAC6的缬氨酸敏感核易位和传递细胞增殖的缬氨酸可用性中起作用的观点。
为了评估膳食VR对体内肿瘤生长的影响,采用HCT116异种移植模型,研究了饮食中不同VR浓度对体重和肿瘤生长的影响;发现0.41%缬氨酸(w/w)的VR饮食显著抑制肿瘤生长,对体重有轻微副作用。进一步使用临床前患者来源的结直肠癌异种移植(PDX)模型,来研究VR在人类癌症中的治疗潜力(图5a)。0.41%(w/w)的VR饮食显著抑制了预防组和治疗组的肿瘤生长(图5b-e)。挽救实验也表明VR以依赖于HDAC6的SE14重复结构域的方式抑制肿瘤进展(图5f-h),VR还显著增强了肿瘤组织中的5hmC水平(图5i、j)。这些发现进一步强调了HDAC6介导的TET2去乙酰化在缬氨酸剥夺诱导的DNA损伤中的关键作用。将VR与PARP抑制剂联合使用,VR显著提高了PARP抑制剂在体外和体内的效果。
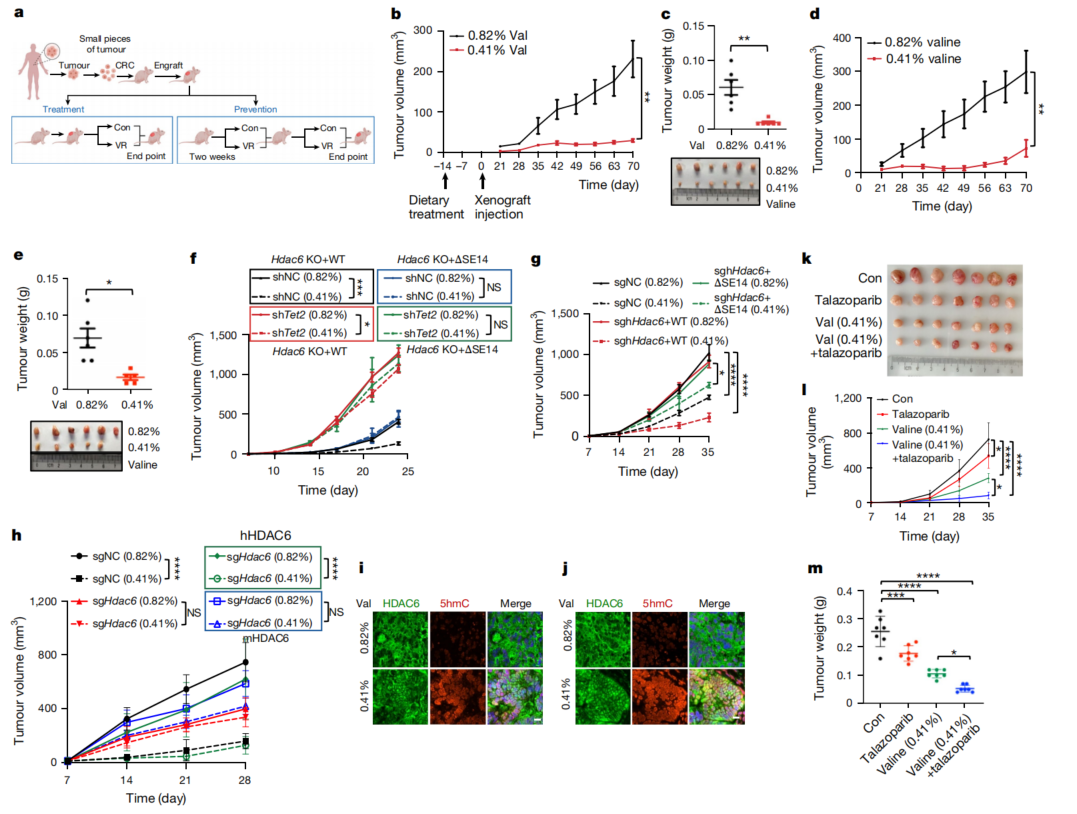
图5 膳食VR通过HDAC6 -TET2轴抑制结肠癌进展
三、研究结论
HDAC6通过灵长类动物特异性的SE14重复结构域直接结合缬氨酸,作为缬氨酸传感器。缬氨酸剥夺导致HDAC6滞留在细胞核中,使TET2去乙酰化,启动活跃的DNA去甲基化,通过胸腺嘧啶DNA糖基化驱动的切除促进DNA损伤。饮食缬氨酸限制抑制异种移植物和患者来源的异种移植物模型的肿瘤生长,并增强PARP抑制剂的治疗效果;显示了饮食缬氨酸限制的癌症治疗潜力。
参考文献:
Human HDAC6 senses valine abundancy to regulate DNA damage.[J]Nature, 2024.