| 时间:2024-11-22 |
2024年发表于《Cell Death Differ》(IF=13.7)
一、研究背景
肝细胞癌(HCC)是最常见的原发性肝癌类型。尽管癌症治疗有所进展,但由于治疗选择有限和高复发率,HCC患者的预后依然不佳,五年生存率低于15%。染色体8q22区域的拷贝数增加在HCC中较为常见,与疾病快速进展和不良预后相关,但该区域的致癌潜力及其具体机制仍不完全明了。
细胞代谢重编程和氧化还原平衡在肝癌进展中发挥重要作用。研究者特别关注了位于染色体8q22区域的ZNF706基因,该基因编码一种C2H2型锌指蛋白,虽然在某些癌症中表达上调,但在肝细胞癌(HCC)中的功能及其作用机制仍不明确。此外,SLC7A11基因也受到关注,它编码一种转运蛋白,对维持细胞内氧化还原平衡至关重要。
二、研究结果
1、ZNF706高表达与HCC患者生存率低相关
ZNF706在肝细胞癌中ZNF706的扩增比例约为8%(图1A)。肝癌组织中的ZNF706 mRNA表达显著高于正常肝组织(图1B)。肝癌中ZNF706的拷贝数也显著增加(图1C)。ZNF706高表达的患者生存率较低(图1D)。在多种HCC细胞系中,ZNF706的表达明显高于正常人肝细胞系(图1E)。与配对的邻近正常组织相比,HCC样本中的ZNF706 mRNA表达明显升高(图1F)。与正常组织相比,所有HCC样本的ZNF707蛋白表达量均显著增加(图1G)。免疫荧光成像显示ZNF706主要定位于细胞核中(图1H,I)。综上所述,这些观察结果表明ZNF706在癌症中过表达,并与HCC患者的低生存率相关。
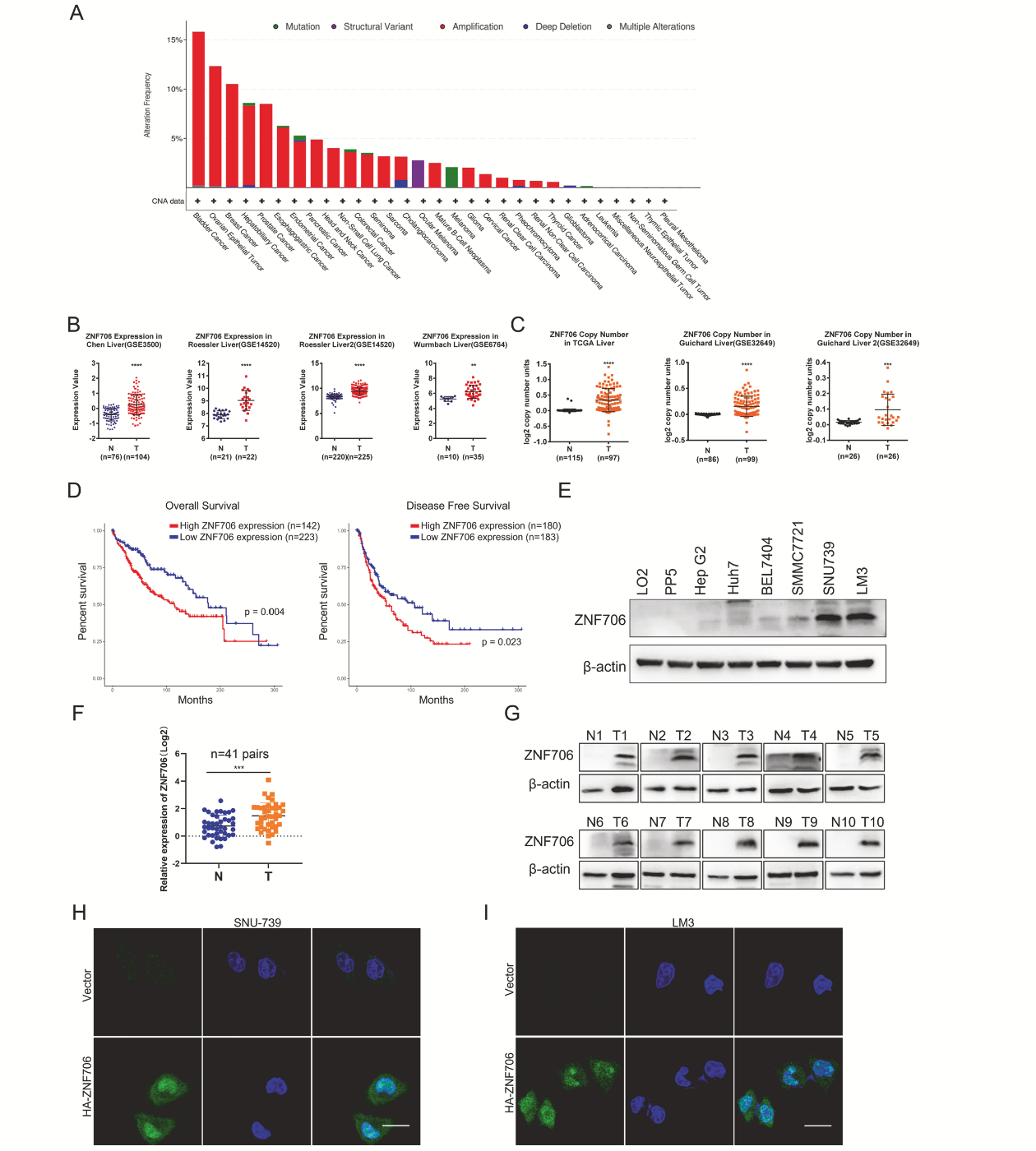
图1 ZNF706在人HCC中上调,可预测HCC患者的不良预后
2、敲低ZNF706在体外和体内抑制HCC细胞的恶性行为
Western Blot和qRT-PCR结果显示,ZNF706在四种HCC细胞系中的表达显著下降(图2A)。ZNF706的敲低显著抑制了SNU-368和LM3细胞的生长(图2B)。相反,ZNF706的过表达促进了SNU-739和LM3细胞的生长(图2C)。此外,ZNF706的敲低或者过表达显著抑制或者促进这几种细胞系的锚定依赖性生长和增殖(图2D-G)。与体外观察结果一致,ZNF706敲低细胞形成的肿瘤的重量和体积显著低于对照细胞的异种移植物(图2H-J)。综上所述,这些结果支持ZNF706在HCC进展中可能发挥致癌作用的观点。
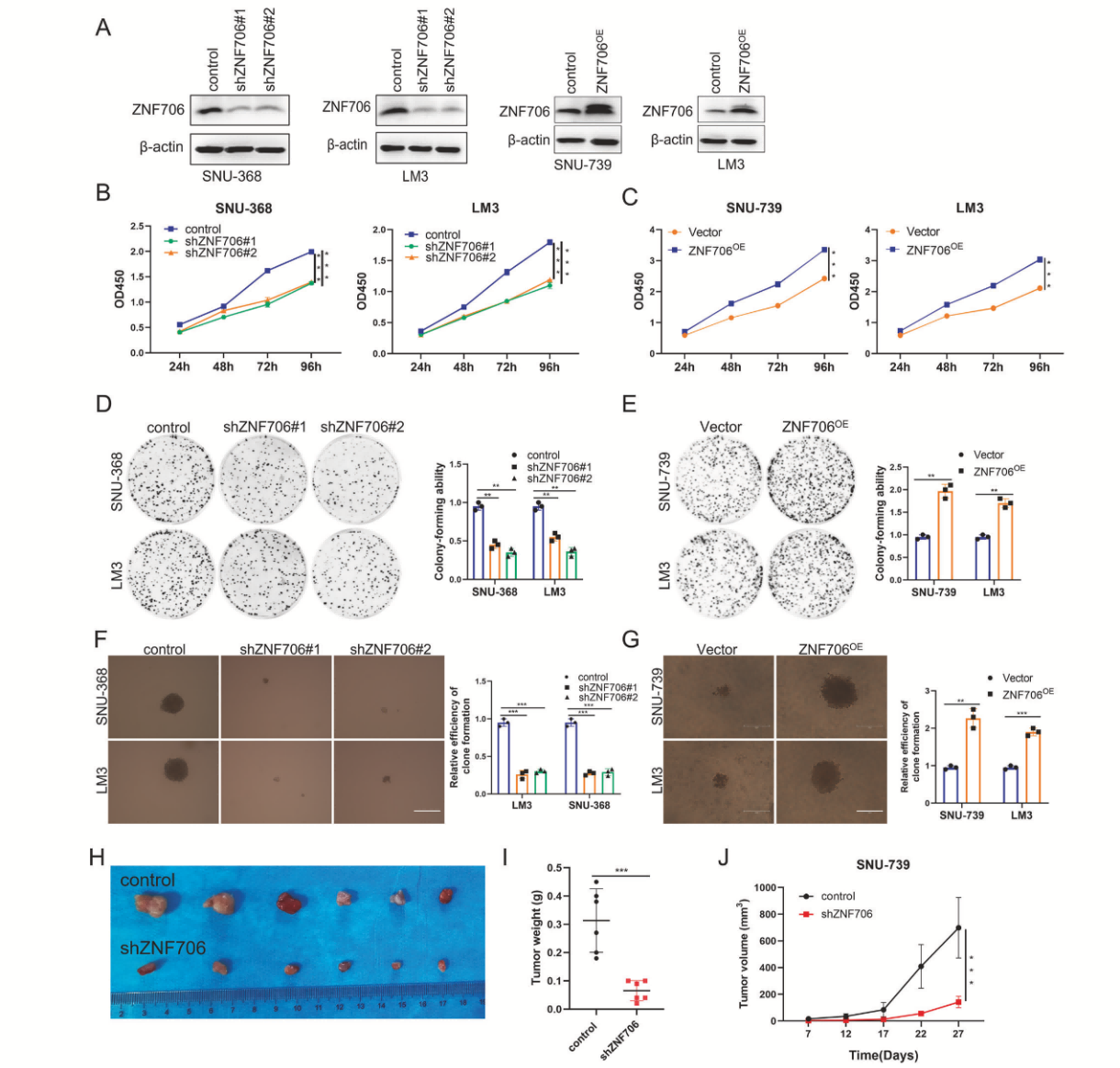
图2 敲低ZNF706在体外和体内抑制HCC细胞的恶性行为
3、ZNF706通过调节SLC7A11的表达促进HCC进展
RNA-seq数据显示,ZNF706敲低可能影响多个基因的表达(图3A)。ChIP-seq数据表明ZNF706结合位点主要集中在基因的启动子区域,其中1512个结合峰与启动子转录起始位点相关。(图3B、C)。GSEA分析表明,ZNF706结合基因富集于多种通路,包括AMPK信号通路、铁死亡和戊糖磷酸通路等(图3D)。RNA-seq和ChIP-seq数据结合,发现了22个与ZNF706表达模式密切相关的重叠基因,其中SLC7A11能够影响细胞内的氧化还原平衡,并作为铁死亡的关键抑制因子(图3E)。Western Blot结果显示,ZNF706敲低或者过表达显著降低了或者提高了SNU-739和LM3细胞中SLC7A11的表达(图3F)。ZNF706与SLC7A11启动子有强烈的结合(图3I-K)。综上所述,本研究首次鉴定出ZNF706结合基序,支持ZNF706和SLC7A11在HCC细胞中存在物理相互作用和功能调节关系。
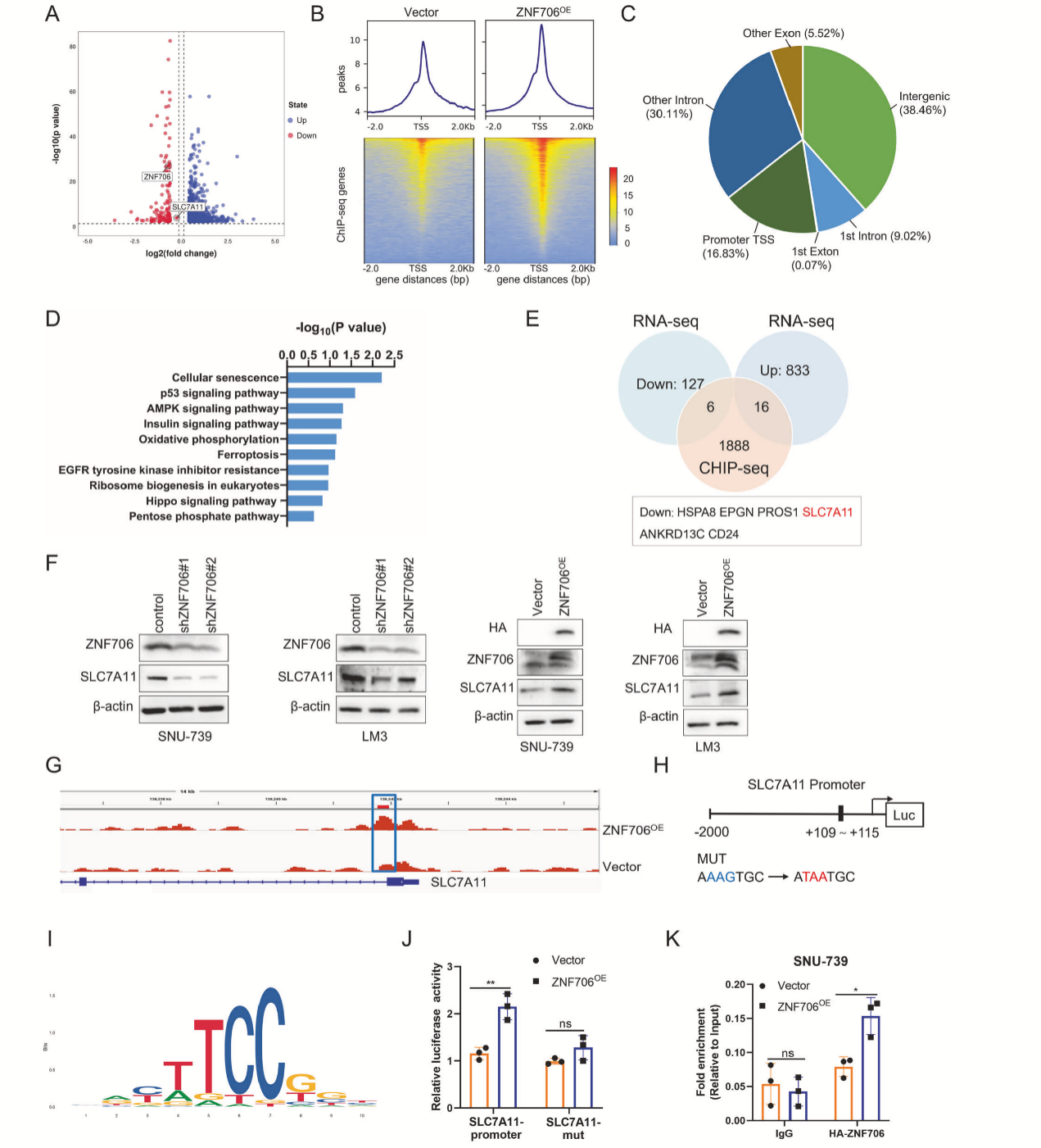
图3 ZNF706通过调节SLC7A11表达促进HCC进展
4、ZNF706的敲低通过降低SLC7A11表达来破坏细胞内氧化还原稳态
ZNF706的敲低显著增加了ERASTIN 诱导的SNU-739和LM3细胞中的脂质过氧化(图4A,C)。ZNF706的过表达显著促进了ERASTIN 诱导的细胞死亡(图4B,D)。HCC细胞中ZNF706敲低后,谷胱甘肽(GSH)水平降低(图4E)。ZNF706敲低的HCC细胞衍生的皮下肿瘤比对照细胞衍生的肿瘤脂质过氧化水平更高(图4F)。与对照肿瘤相比,ZNF706敲低肿瘤中的GSH水平降低(图4G)。免疫组织化学(IHC)结果显示,ZNF706敲低肿瘤的4HNE染色增加(图4H)。同时检测到,ZNF706敲低肿瘤的细胞死亡量增加(图4I)。ZNF706过表达降低了脂质ROS水平和细胞死亡率,并显著提高了GSH水平(图4J-L)。这些数据表明,ZNF706的缺失通过抑制SLC7A11的表达和加速HCC细胞的铁死亡来抑制HCC的进展。
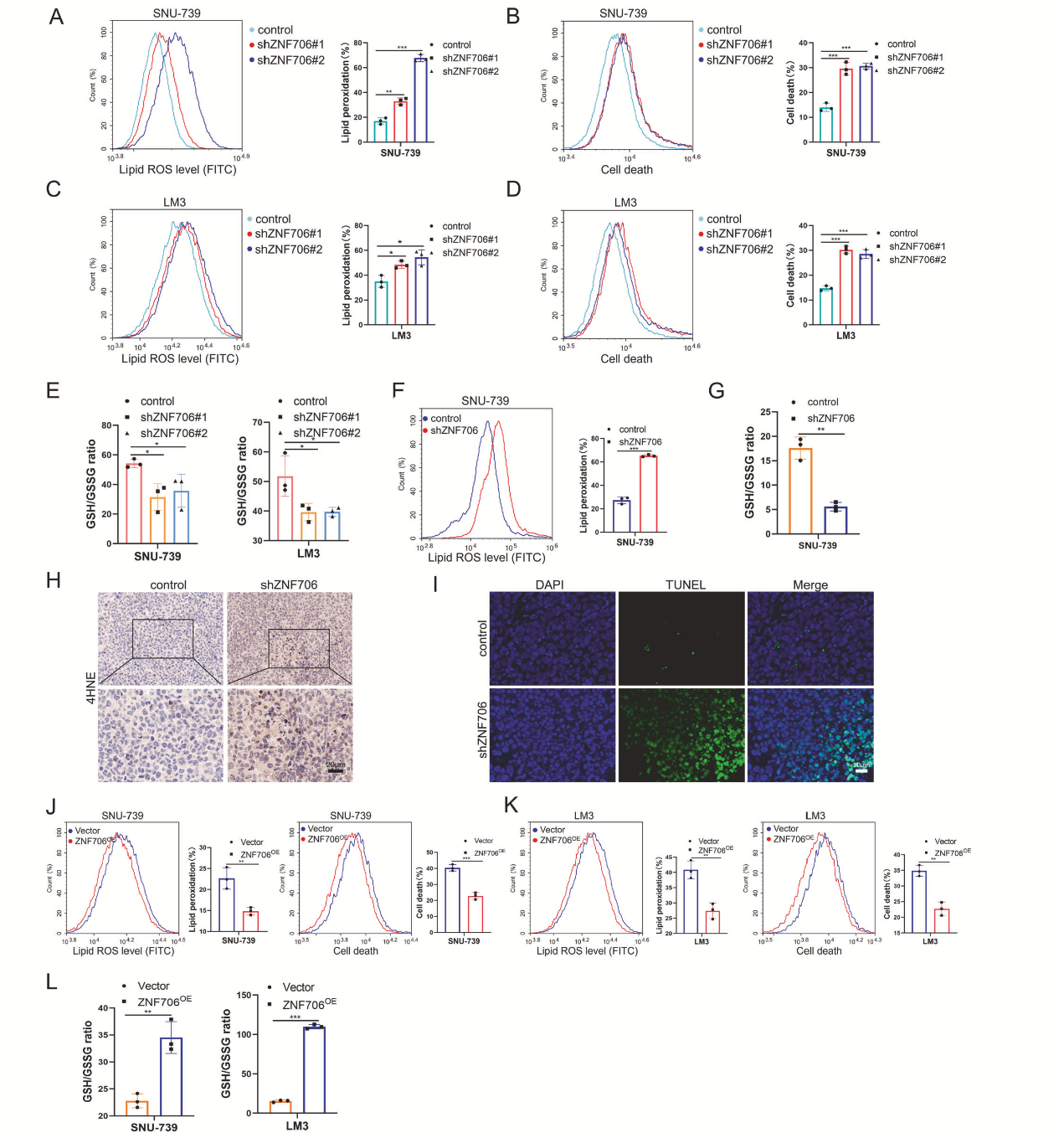
图4 敲低ZNF706增加了脂质ROS积累并破坏了氧化还原稳态
ZNF706敲低HCC细胞中SLC7A11过表达的恢复部分ZNF706敲低诱导的细胞生长抑制,以及在SNU-739和LM3中HCC细胞的生长率(图5A、B)。在体内试验中,ZNF706敲低中SLC7A11过表达恢复了ZNF706敲低诱导的异种移植物生长抑制情况(图5C-E)。4HNE水平的测表明,与对照肿瘤相比,ZNF706敲低肿瘤的细胞死亡增加;SLC7A11过表达显著降低了这些增加(图5F,G)。ZNF706敲低HCC细胞中SLC7A11过表达挽救了ZNF706敲低诱导的氧化还原稳态破坏,包括ERASTIN 诱导的脂质过氧化水平、ERASTIN 诱导的细胞死亡以及GSH的表达水平(图5H-L)。综上所述,这些结果表明SLC7A11对ZNF706介导的HCC恶性进展和对铁死亡的反应性至关重要。

图5 SLC7A11过表达部分挽救了ZNF706敲低诱导的氧化还原稳态破坏
5、ZNF706被MYC转录激活
利用TCGA、JASPAR和PROMO数据库预测ZNF706调控机制,发现MYC可能是调节ZNF707表达的转录因子(图6A),并观察到,在HCC样本中,MYC与ZNF706或SLC7A11的表达存在显著的正相关关系(图6B)。IHC分析,结果显示它们在相同样本中的表达变化一致且呈正相关(图6C、D)。Western blot结果表明,它们在测试的细胞系中表现出相似的表达模式(图6E、F)。不同剂量的MYC抑制剂JQ1处理后,发现JQ1显著降低了ZNF706的表达,这与MYC蛋白水平的抑制一致(图6G)。MYC和ZNF706的mRNA表达也显著降低(图6H)。MYC的敲低导致ZNF706和SLC7A11的mRNA水平和蛋白表达显著下降(图6I,J)。
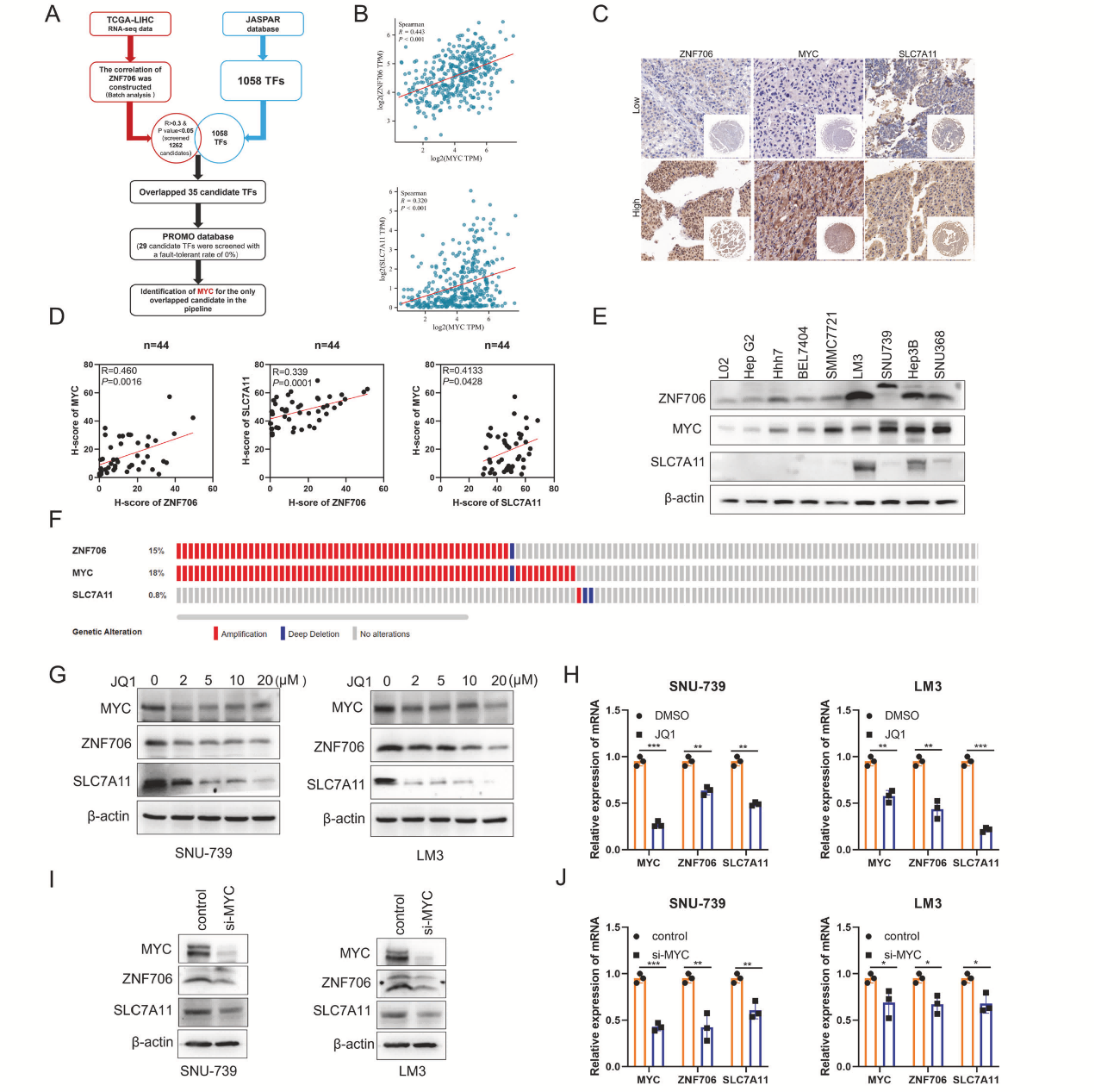
图6 ZNF706、MYC和SLC7A11在肝癌中的协调表达
使用两种不同的shRNA敲低MYC也产生了类似的结果(图7A,B)。相反,MYC的过表达显著提高了HCC细胞中ZNF706和SLC7A11的表达(图7C,D)。双荧光素酶报告实验显示第一个结合位点为MYC的真实响应元件(图7E)。ChIP-qPCR结果进一步证实,MYC与ZNF706启动子区域存在物理互作(图7F)。综上所述,这些数据表明MYC在HCC细胞中转录激活了ZNF706。
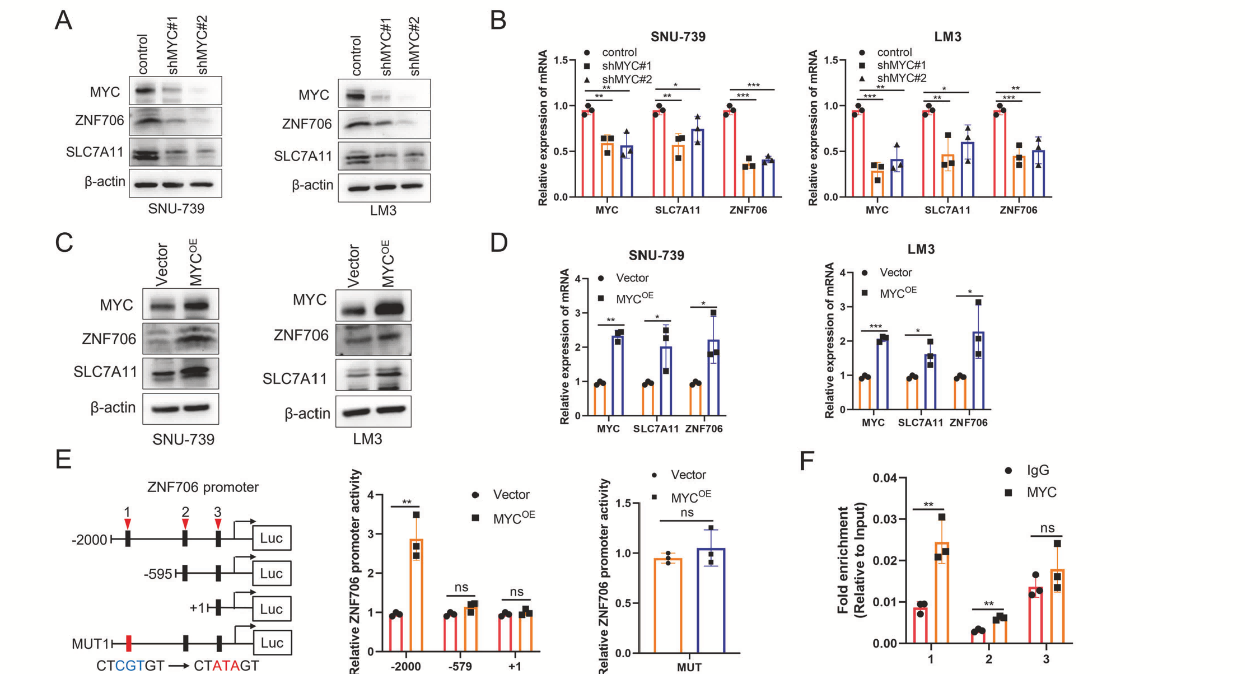
图7 MYC转录激活ZNF706,MYC的敲低通过降低SLC7A11表达来促进铁死亡反应
6、ZNF706的过表达部分恢复MYC敲低诱导的细胞内氧化还原反应破坏
MYC敲低的HCC细胞中,ERASTIN诱导的ROS生成和细胞死亡显著增加(图7G, H, J, K)。相反,MYC的过表达减少了脂质ROS的生成和细胞死亡(图7M, N)。MYC敲低后,GSH水平也下降(图7I, L)。然而,在MYC敲低HCC细胞中的过表达ZNF706能够恢复MYC敲低对HCC细胞增殖能力的抑制作用,还能恢复其体内成瘤能力(图8A-E)。与对照组肿瘤相比,4HNE染色显示MYC敲低肿瘤的细胞死亡增加,而ZNF706的过表达则降低了ERASTIN诱导的脂质过氧化水平和细胞死亡率,也提高了GSH水平(图8F-L)。这些结果表明,ZNF706在维持MYC介导的细胞内氧化还原平衡中起关键作用。
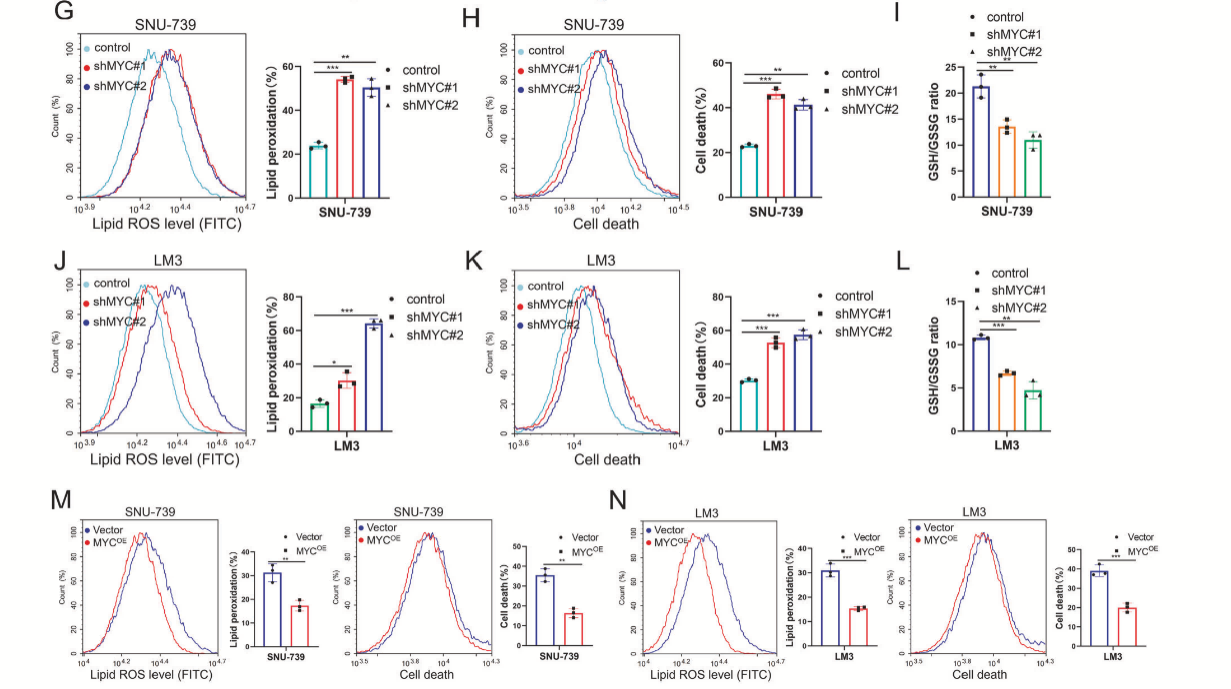
图7 MYC转录激活ZNF706,MYC的敲低通过降低SLC7A11表达来促进铁死亡反应
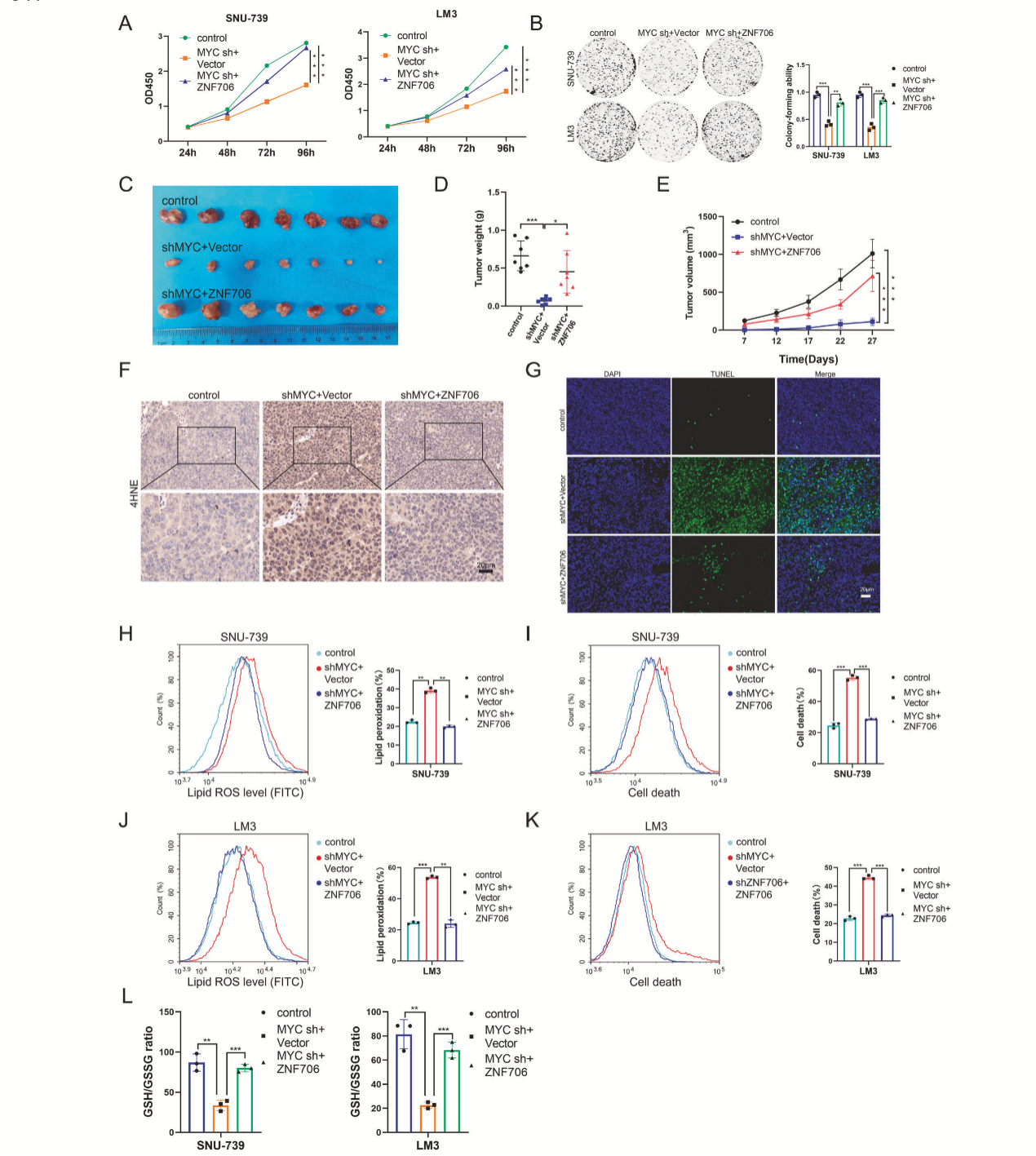
图8 ZNF706的恢复部分挽救了MYC敲低诱导的氧化还原稳态破坏
7、敲低ZNF706使HCC细胞对索拉非尼敏感
抑制ZNF706显著增加HCC细胞死亡和对索拉非尼的敏感性(图9A、B)。相反,ZNF706过表达减弱了索拉非尼诱导的HCC细胞死亡(图9C、D)。在小鼠异种移植模型中,ZNF706敲低细胞形成的皮下肿瘤比对照细胞形成的肿瘤小,且索拉非尼对ZNF706敲低细胞形成的肿瘤生长抑制更明显(图9E-G)。因此,这些结果表明抑制ZNF706可增强癌症细胞对索拉非尼的敏感性。
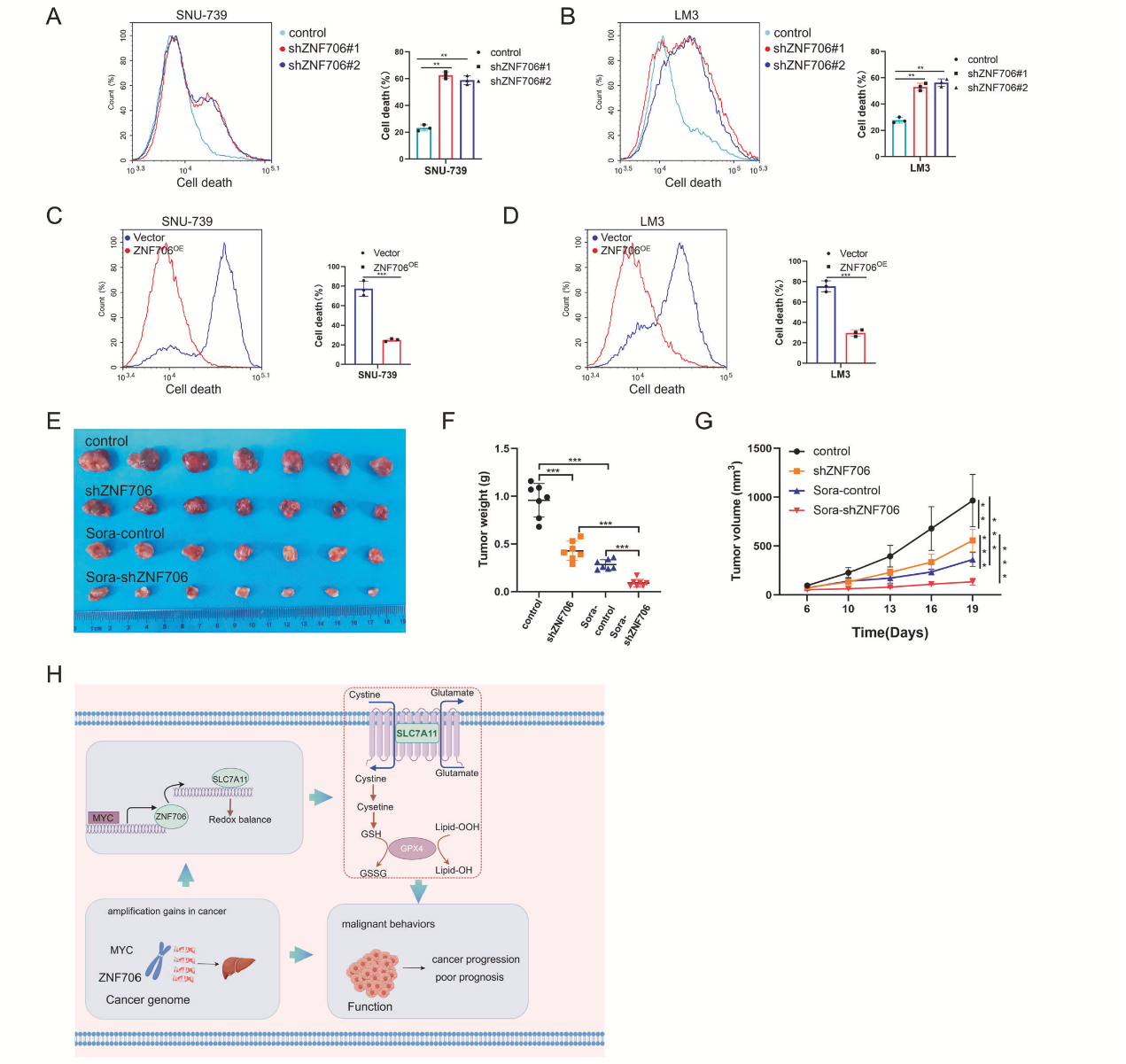
图9 ZNF706的敲低使HCC细胞对索拉非尼敏感
三、研究结论
ZNF706在肝细胞癌(HCC)中的表达升高,其敲低可抑制肿瘤生长,并与患者不良预后相关。机制上,ZNF706通过调控SLC7A11的表达和铁死亡过程,维持氧化还原平衡。ZNF706是MYC的直接靶点,而MYC的敲低会减弱SLC7A11介导的氧化还原稳态。MYC-ZNF706-SLC7A11调控回路在HCC进展中发挥关键作用,为HCC治疗提供了潜在靶点。
参考文献:
A novel MYC-ZNF706-SLC7A11 regulatory circuit contributes to cancer progression and redox balance in human hepatocellular carcinoma. Cell Death Differ. 2024.