| 时间:2024-11-01 |
2023年发表于《Nature Communications》(IF=14.7)
一、研究背景
CD4+辅助性T细胞谱系的极化是由特定的信号转导、局部细胞因子和转录因子调控的。表观遗传因素,如组蛋白修饰和DNA甲基化,通过介导特定转录因子和细胞因子的表达参与不同Th细胞系的分化。RNA修饰已被证明参与多种T细胞免疫过程中,它是否直接调控Th17细胞功能的维持尚未被研究。Th17细胞是一类促炎CD4+ T细胞,分泌IL-17A、IL-17F等细胞因子,主要参与炎症反应和多种自身免疫性疾病。视黄酸孤儿受体RoRγt是调控Th17细胞分化的关键转录因子。Th17细胞命运决定的潜在机制仍不清楚。
二、研究结果
1、Nsun2对Th17细胞的稳态至关重要
构建了Nsun2敲除(Nsun2−/−)小鼠模型,Nsun2的缺失特异性地抑制了脾脏、PBMCs和淋巴结中IL-17A+ Th17细胞的百分比(图1c,d),只有Th17细胞在Nsun2缺失后被特异性抑制。构建了T细胞特异性Nsun2缺失的小鼠。与在全局Nsun2敲除小鼠中观察到的表型一致(图1c,d),T细胞异性敲除Nsun2确实阻碍了体外Th17细胞的分化(图1e,f)。由于RoRγt是Th17细胞的谱系转录因子,Nsun2不影响Th17细胞中RoRγt的表达(图1g)。用地高辛阻断RoRγt,发现Th17细胞的体外分化被显著抑制。在Nsun2基因敲除的背景下,抑制RoRγt并没有导致Th17细胞分化进一步减少(图1i)。因此,假设Nsun2和RoRγt在同一信号轴上坐标以控制Th17谱系。
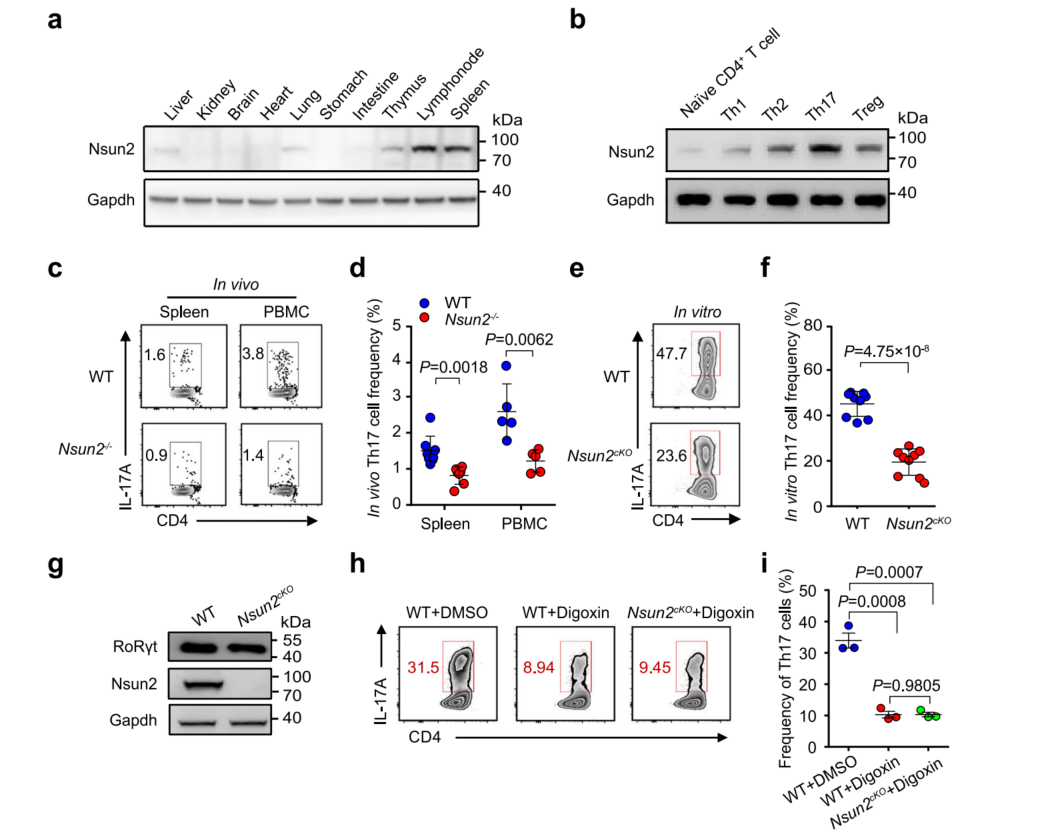
图1 Nsun2对Th17的稳态至关重要
2、Nsun2直接与RoRγt相互作用
转录因子RoRγt在Th17细胞中与Nsun2内在相互作用的候选蛋白中排名第一,与Nsun2有强烈的相互作用(图2a)。Co-IP和体外GST-pull-down证实了Nsun2和RoRγt之间的直接相互作用(图2b,c)。PLA和免疫荧光显示Nsun2与细胞核中的RoRγt相互作用(图2d)。ATAC-seq测定了染色质可及性的变化,结合野生型Th17细胞的公开RoRγt ChIP-seq数据,发现RoRγt结合与Th17细胞中发现的开放染色质区域相关。Nsun2不影响RoRγt的染色质结合效率,也不影响caRNA的丰度。总之,尽管Nsun2缺失与转录因子RoRγt直接相关,Nsun2缺失对其染色质可及性和整体基因转录没有影响。
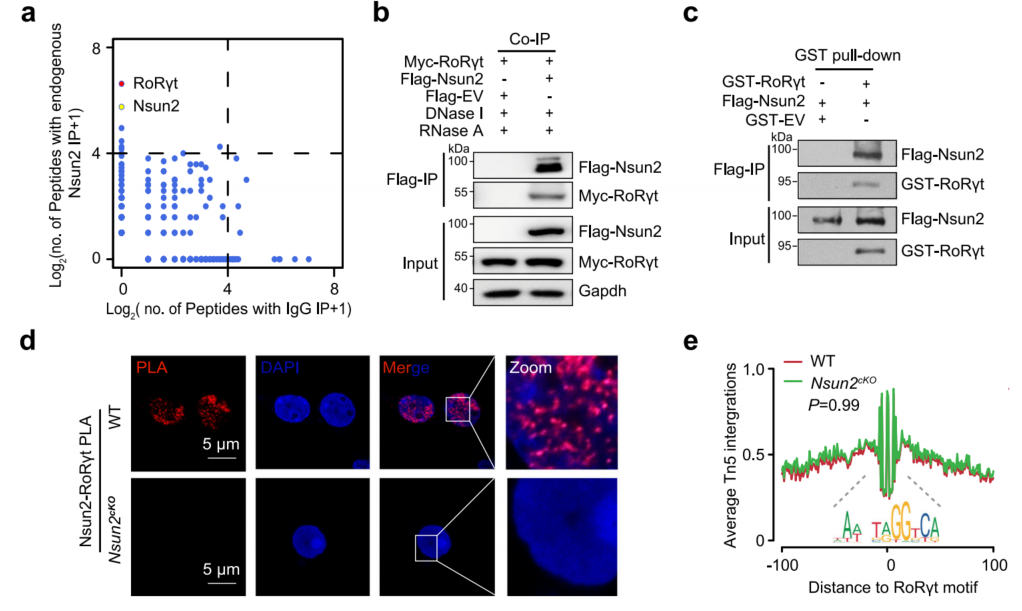
图2 Nsun2与RoRγt结合,促进Th17相关基因上的m5C形成
3、Nsun2与RoRγt结合,催化RNA m5C的形成
Nsun2是一种m5C甲基转移酶,推测Nsun2可能被募集到RoRγt靶点上,促进m5C的形成。Nsun2的RIP-seq和m5C的MeRIP-seq,81.1%的Nsun2结合基因被m5C修饰,并且在其基因体区域上也被RoRγt优先靶向(图2f)。RoRγt的启动子结合效率与Nsun2和m5C对靶基因的富集成正比(图2g,h)。发现56.6%的RoRγt靶标被Nsun2占据,并被m5C修饰(图2i)。GO富集分析表明,这些基因在细胞内信号转导和T细胞受体信号通路中显著富集(图2j)。Th17特异性RNA,如Il17a和Il17f,这两个基因的染色质相关RNA(caRNAs)在Th17细胞中同时被Nsun2和RoRγt结合(图2k,1)。此外,m5C MeRIP-qPCR显示,Il17a和Il17f RNA也被m5C修饰(图2m,n)。综上所述,Nsun2与RoRγt结合,通过直接甲基化Th17特异性转录物来控制Th17细胞功能稳态;而RoRγt的染色质可及性和整体转录起始不受这一过程的影响。
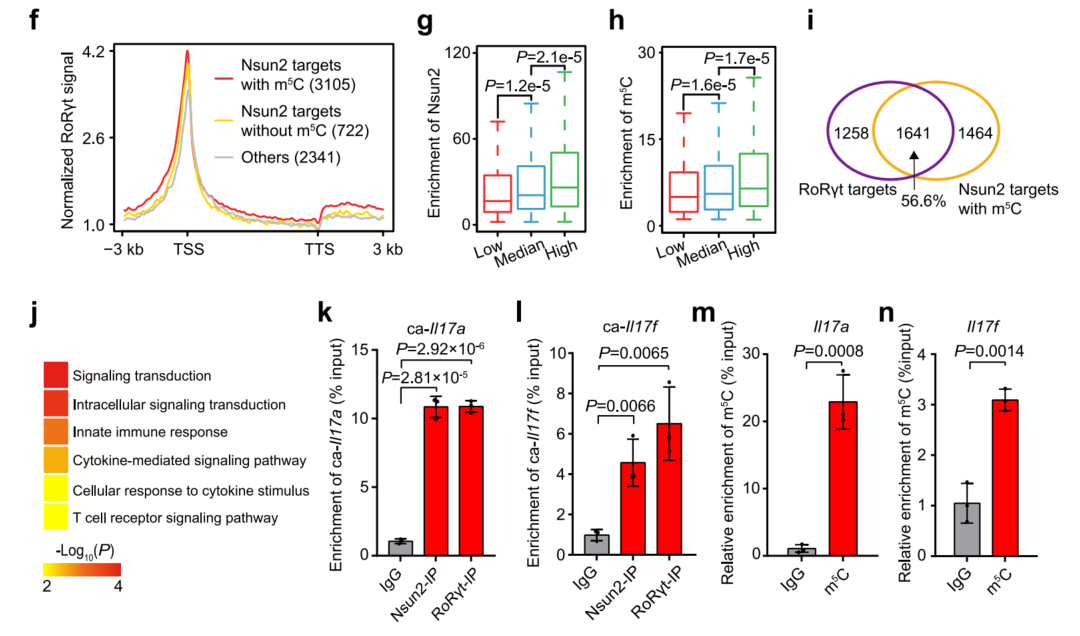
图2 Nsun2与RoRγt结合,促进Th17相关基因上的m5C形成
4、Nsun2通过基于m5C的mRNA的稳定性来控制Th17的稳态
对野生型和缺乏Nsun2的Th17细胞的进行了RNA-seq,40%的下调基因是Nsun2靶向的,并被m5C修饰。构建了野生型Nsun2-WT和突变型的Nsun2(Nsun2-c321a)(图3c)。过表达Nsun2可以挽救Th17细胞中Il17a和Il17f mRNA水平的下降(图3d)。野生型Nsun2也挽救了Nsun2cKO中IL-17A+ Th17细胞的减少(图3e,f)。这些发现表明,Nsun2固有的甲基转移酶活性对于Th17细胞的产生和功能维持至关重要。Nsun2的缺失显著加速了Il17a和Il17f mRNA的降解(图3g)。合成了两个迷你基因报告基因:Il17a-C(未修饰C)和Il17a-m5C(图3h),Il17a-m5C报告RNA比Il17a-C报告RNA更稳定。综上所述,Nsun2通过调节依赖于m5C修饰的关键细胞因子mRNA的稳定性来维持Th17细胞的稳态。
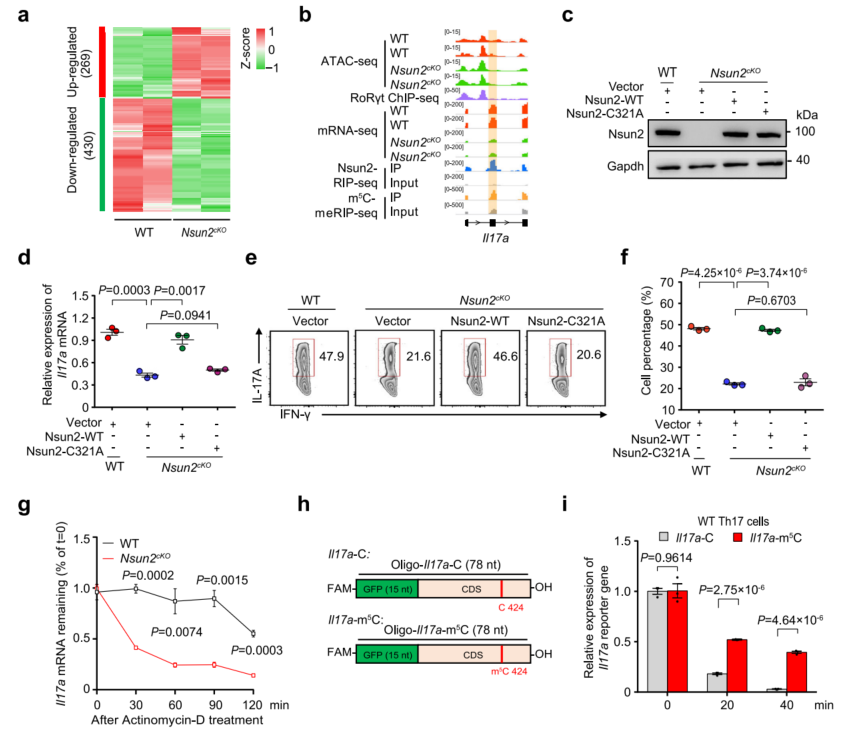
图3 Nsun2通过m5C介导的mRNA稳定性控制Th17细胞的生成
5、在T细胞中靶向Nsun2可改善结肠炎的发展
Th17细胞大量浸润炎症肠道,分泌IL-17A促炎细胞因子募集新嗜细胞,从而在炎症性肠病(IBD)患者中触发和放大炎症发病机制。在Nsun2−/−和野生型的幼崽中用DSS诱导结肠炎疾病,Nsun2−/−小鼠结肠炎的发展受到限制。T细胞中Nsun2特异性缺失也减轻了结肠炎的发生(图4a-c)。与对照小鼠相比,Nsun2cKO小鼠中Th17细胞的频率显著降低(图4d),而Th1、Th2和Treg细胞的频率较小或不变(图4e-g),Nsun2cKO小鼠结肠中Th17细胞浸润减少(图4h,i),表明靶向T细胞中的Nsun2通过抑制Th17细胞功能减轻结肠炎的进展。Nsun2cKO小鼠显著减少了受体小鼠肠道固有层中Th17细胞的浸润,没有出现结肠炎特征(图4j,k)。特异性抗体阻断IL-17A或IL-17A和IL-17F可保护受体小鼠免于结肠炎的发展,总的来说,这些数据支持靶向T细胞中的Nsun2改善结肠炎的发展。
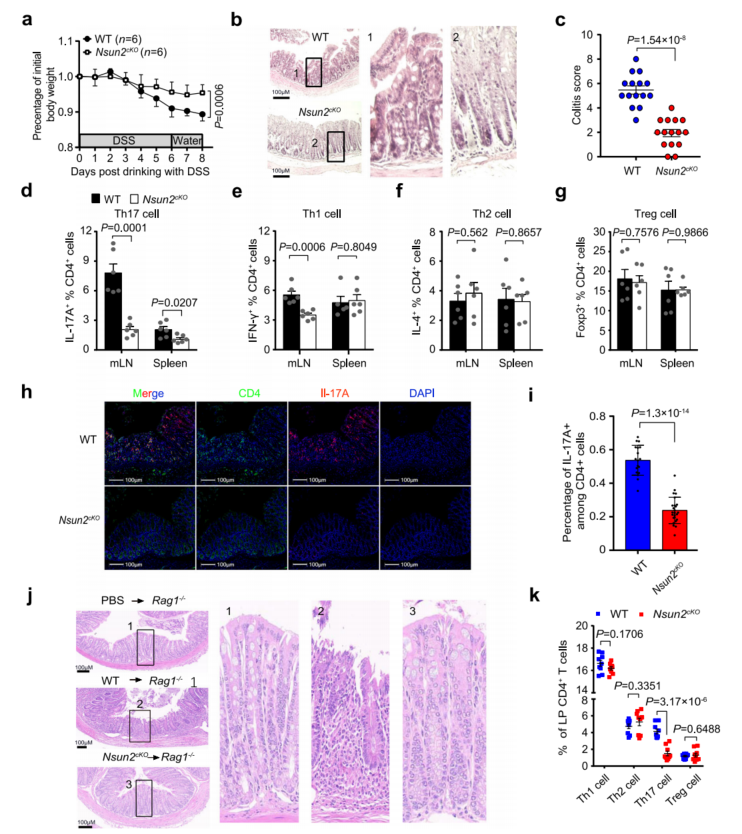
图4 在T细胞中靶向Nsun2可改善Th17介导的自身免疫
6、在结肠炎进展期间Nsun2靶向IL-17A/IL-17F
阻断IL-17A、IL-17F或两者均可显著缓解DSS诱导的野生型小鼠结肠炎的发展,同时阻断两者的效果更明显。相反,通过注射重组小鼠IL-17A、IL-17F或两者同时注射,可以逆转DSS诱导的Nsun2cKO小鼠结肠炎进展的缓解(图5a-f)。总之,表明IL-17A和IL-17F都是Th17细胞中Nsun2的下游靶点,并参与结肠炎的进展。
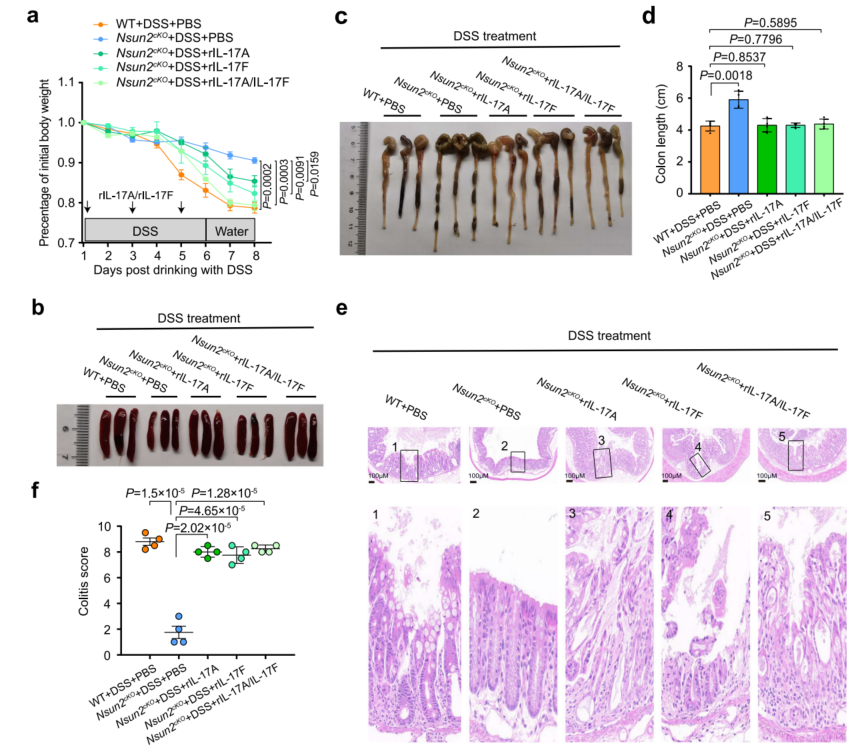
图5 在DSS诱导的Nsun2cKO小鼠中,补充rIL-17A/rIL-17F可逆转结肠炎的发展
7、Nsun2缺失可逆转IL-17R+细胞的病理改变
为了揭示Nsun2在结肠炎微环境中的调控途径,对野生型和Nsun2cKO小鼠的结肠进行了单细胞RNA-seq分析。单细胞谱被划分为15个亚群,细胞计数从66到5253(图6a,b),其中上皮细胞(24.4%)和B细胞(25.8%)是富集程度最高的两个亚群。在野生型组中,发现15种细胞类型中有9种在结肠炎期间发生了异常变化,这些异常变化大部分可以通过Nsun2耗竭来逆转(图6c)。所有获救的细胞类型都表达IL-17受体(图6d)。这些结果表明,T细胞特异性Nsun2的缺失,通过优先逆转表达IL-17受体的细胞的病理改变,从而阻碍结肠炎的发展。
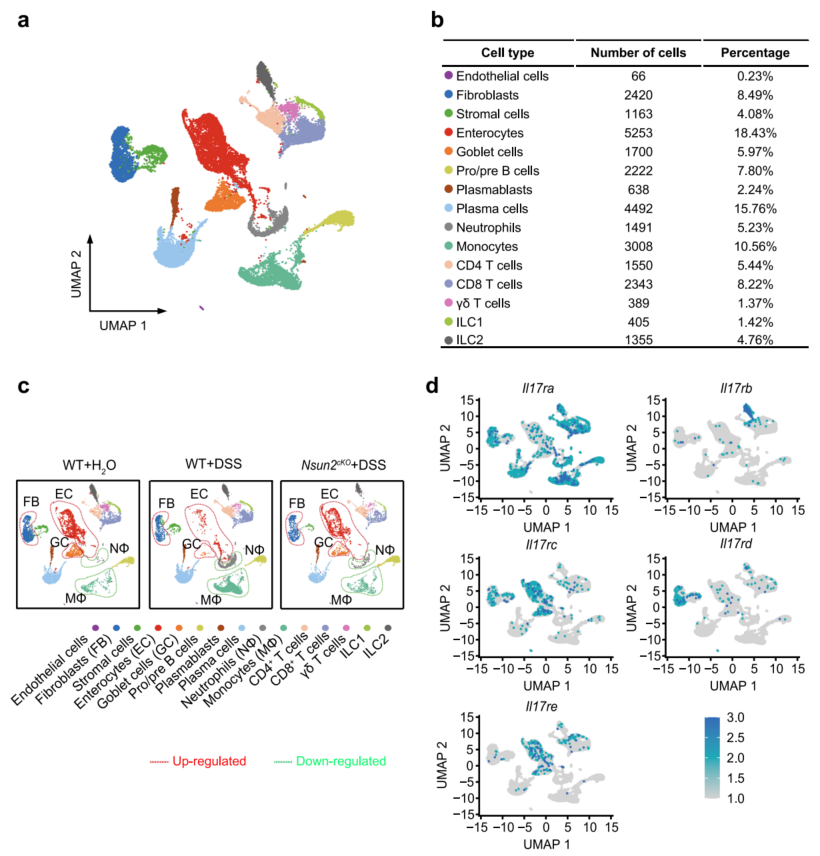
图6 Nsun2缺失通过破坏Th17细胞与IL-17受体表达细胞之间的细胞间通信来减轻结肠炎的发展
三、研究结论
小鼠CD4+ T细胞中甲基转移酶Nsun2的缺失特异性抑制Th17细胞分化并减轻Th17细胞诱导的结肠炎发病机制。RoRγt可以将Nsun2招募到其靶标的染色质区域,包括Il17a和Il17f,导致转录偶联m5C的形成,从而增强mRNA的稳定性;Nsun2是自身免疫性疾病的潜在治疗靶点。
参考文献:
Nsun2 coupling with RoRγt shapes the fate of Th17 cells and promotes colitis.[J]Nature Communications, 2023.