| 时间:2024-10-11 |
2023年发表于《Nucleic Acids Research》(IF=16.6)
一、研究背景
白色脂肪组织是全身性能量平衡和葡萄糖稳态的关键调节器,脂肪形成过程受到严格调控。对人类细胞在表观遗传学和转录后水平上的脂肪形成机制研究较少。人类基因通过选择性剪接(AS)来编码多种具有不同功能的蛋白质。RNA结合蛋白(RBP)是RNA剪接的主要调节因子,RBP介导的AS在脂肪细胞前承诺和终末分化中发挥重要作用。NOVA是一个众所周知的神经元特异性KHtype RBP蛋白家族(包括NOVA1和NOVA2),调节选择性剪接和聚腺苷化,近年来有报道称NOVA在代谢相关细胞中发挥重要作用。在小鼠和人类中,NOVA在白色脂肪生成(代谢紊乱的主要因素)中的作用仍然未知。
二、研究结果
1、剪接因子NOVA1是hMSCs脂肪细胞分化所必需的
作为剪接因子的RBP,是细胞类型特异性细胞分化转录后控制的关键介质,在hASCs的成脂分化过程中,几个剪接因子发生了动态变化(图1A)。qPCR证实,RBM38和NOVA1以时间依赖性的方式显著上调(图1B)。Rbm38已有报道,将重点放在NOVA1上,发现它的上调在脂肪形成中是特异性的(图1C)。NOVA1逐渐上调,脂肪细胞特征也随之增加(图1D)。NOVA1敲低后的基因表达谱,与脂质合成相关的ACSL1、FASN、LPL、PLIN1、LPIN1、ADIPOQ等基因显著下调(图1F):NOVA1过表达促进了hASCs的成脂潜能。结果表明,NOVA1是hMSCs脂肪形成所必需的。
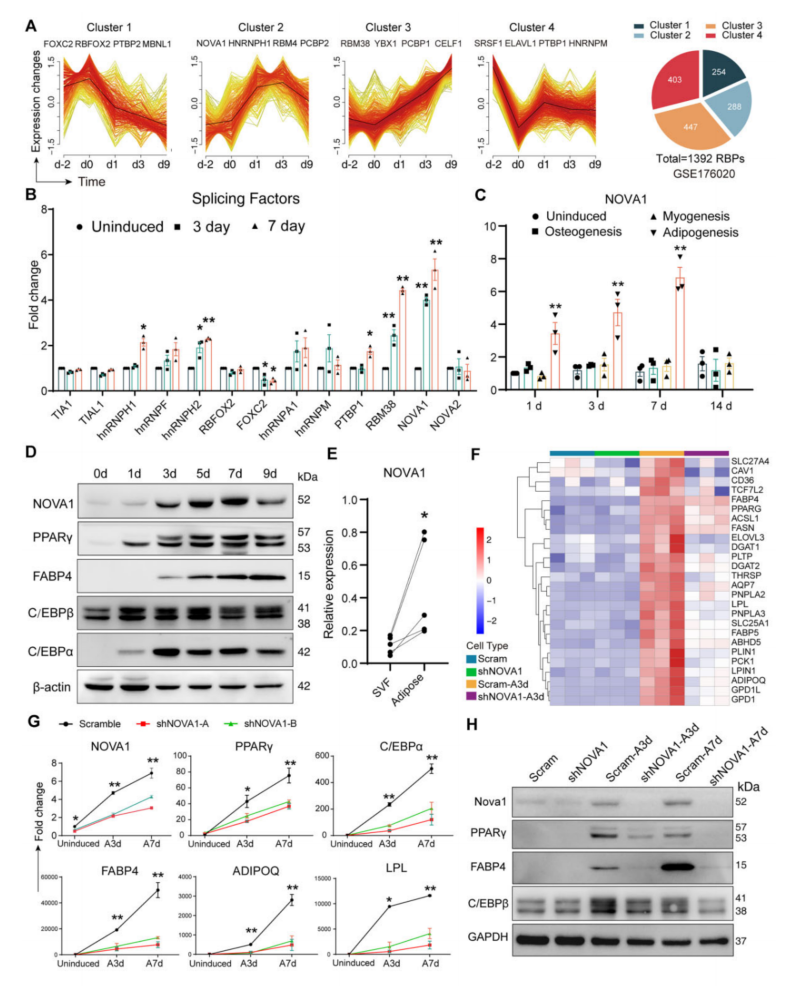
图1 hASCs的脂肪生成需要NOVA1
2、NOVA1可以保护hASCs免受脂肪形成过程中UPR的过度激活
为了探索NOVA1参与脂肪形成过程的细胞过程和剪接事件,进行了RNA-seq。在NOVA1敲低组中下调的基因(图2A)在“脂质代谢”过程中富集(图2B);上调基因主要参与“未折叠蛋白反应(UPR)”或“PERK调节基因表达”,UPR指标表达普遍升高(图2C)。qRT-PCR证实了其表达(图2D)。XBP1是UPR的重要组成部分,NOVA1基因敲除增强了成脂诱导前后hASCs中的XBP1(图2E)。结果表明,NOVA1敲低触发了hASCs过程中UPR的过度激活。在hASC脂肪生成过程中,NOVA1表达的增加有助于微调UPR,而UPR与脂肪生成和脂肪生成密切相关(图2G-J)。
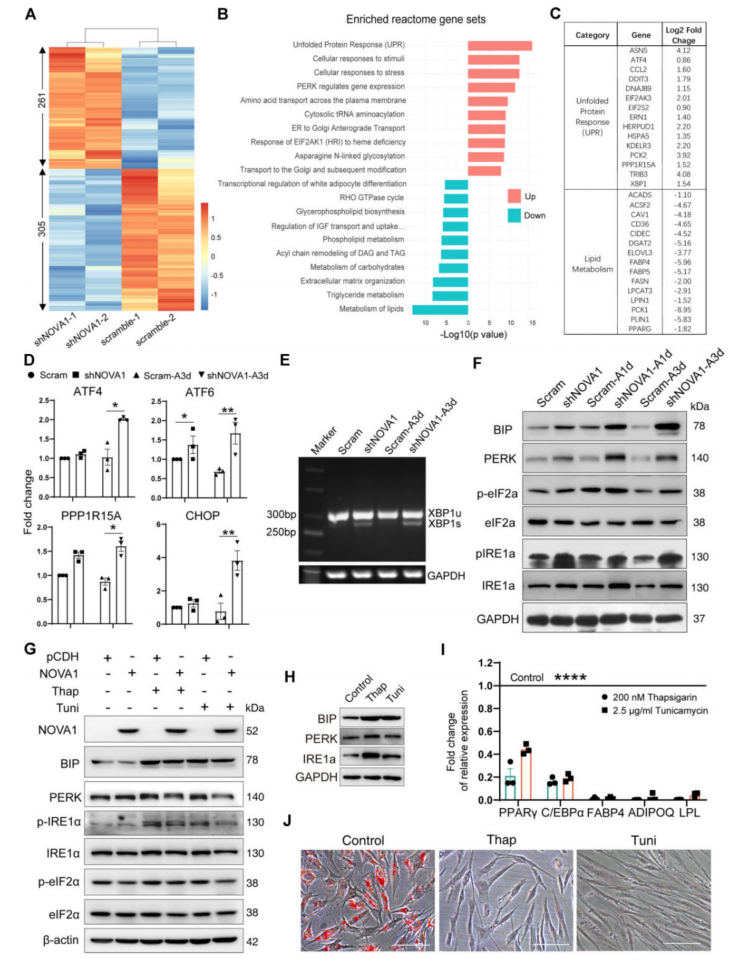
图2 NOVA1缺失导致hASCs脂肪形成过程中UPR的过度激活
3、CLIP-seq分析揭示了在脂肪形成过程中,由NOVA1调控的AS谱
为了确定NOVA1在hASC脂肪形成过程中的功能靶点,做NOVA1的CLIP-seq鉴定出61499个高可信度的非rRNA峰,在hASCs中存在稳健且高度可重复的NOVA1-RNA相互作用(图3A)。68.48%的峰定位在内含子中(图3C)。结合CLIP-seq和RNA-seq,鉴定了46个在hASCs脂肪形成过程中带有nova1连接的AS的基因(图3E),发现了AS的主要模式(图3F)。在脂肪形成过程中上调的CSAD、LETMD1和VWCE的转录本在NOVA1敲低的细胞中显著降低。而DNAJC10和PLEC的某些转录本则表现出相反的变化。DNAJC10在未折叠分泌蛋白的er相关降解(ERAD)中发挥重要作用。NCOR2(也被称为SMRT)是一种核受体的辅抑制因子,可以作为一个成脂的守门人。因此,继续研究了DNAJC10或NCOR2的表达和AS是否可以解释NOVA1缺失导致的脂肪生成受损和UPR过度活化。
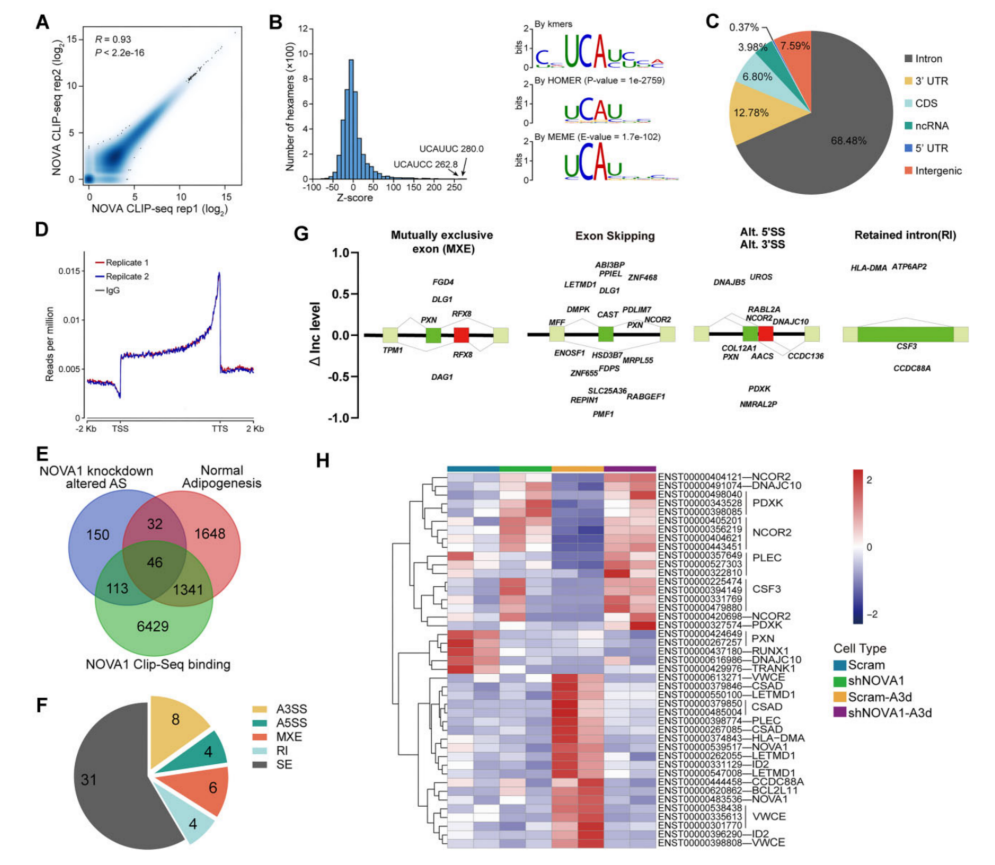
图3 CLIP-seq分析揭示了hASCs脂肪形成过程中NOVA1-RNA的相互作用及其对剪接的调控
4、NOVA1缺失导致DNAJC10剪接异常和内质网应激过度激活
CLIP-seq和RNA-seq显示,NOVA1结合reads在剪接位点周围,NOVA1敲除后,12外显子部分保留11内含子的DNAJC10变异明显增加(图4B),NOVA1促进了DNAJC10蛋白编码亚型的剪接,而不是非编码亚型的剪接((图4C-E)。进一步探讨了DNAJC10的降低是否会影响到UPR和脂肪的形成。在hASCs中敲除DNAJC10,发现UPR指标显著升高(图4F)。DNAJC10敲低也削弱了hASCs的成脂分化潜能(图4F-H)。
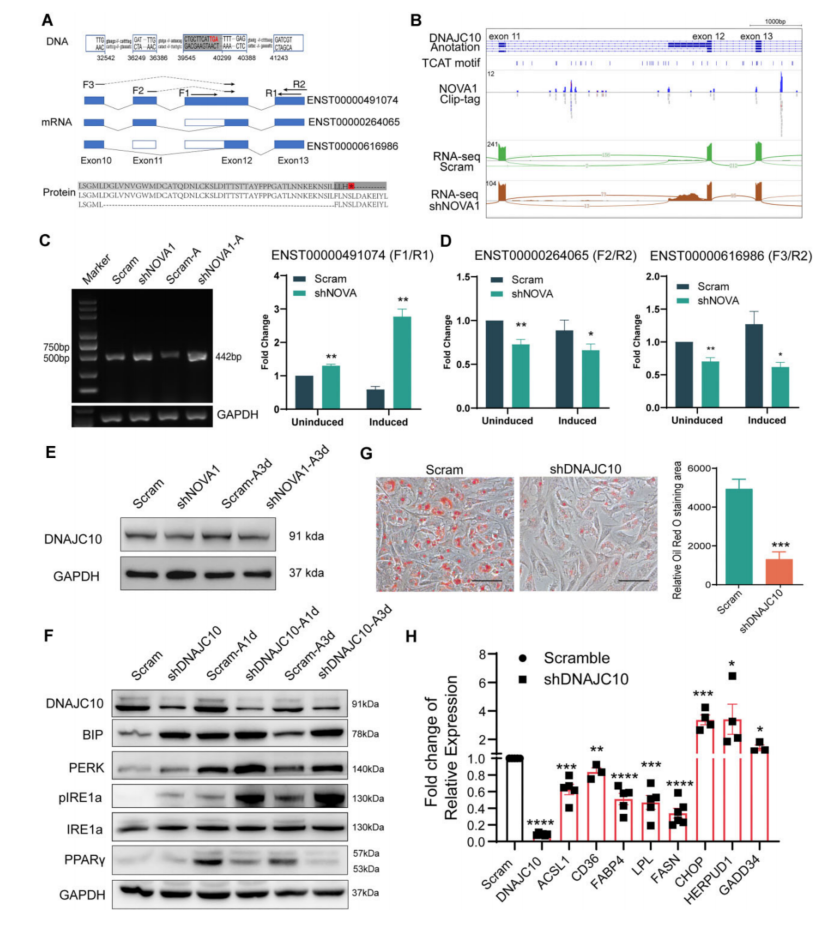
图4 NOVA1缺失导致DNAJC10剪接异常,功能蛋白表达降低
为了研究DNAJC10在NOVA1调控的脂肪形成和UPR中的作用,DNAJC10过表达部分但显著拯救了在NOVA1敲低hASCs后3天的感应(图5),过表达DNAJC10显著抑制了NOVA1敲低导致的脂滴减少(图5D-F)。总之,异常的DNAJC10剪接在NOVA1敲低诱导的UPR过度激活和脂肪形成损伤中发挥了作用。
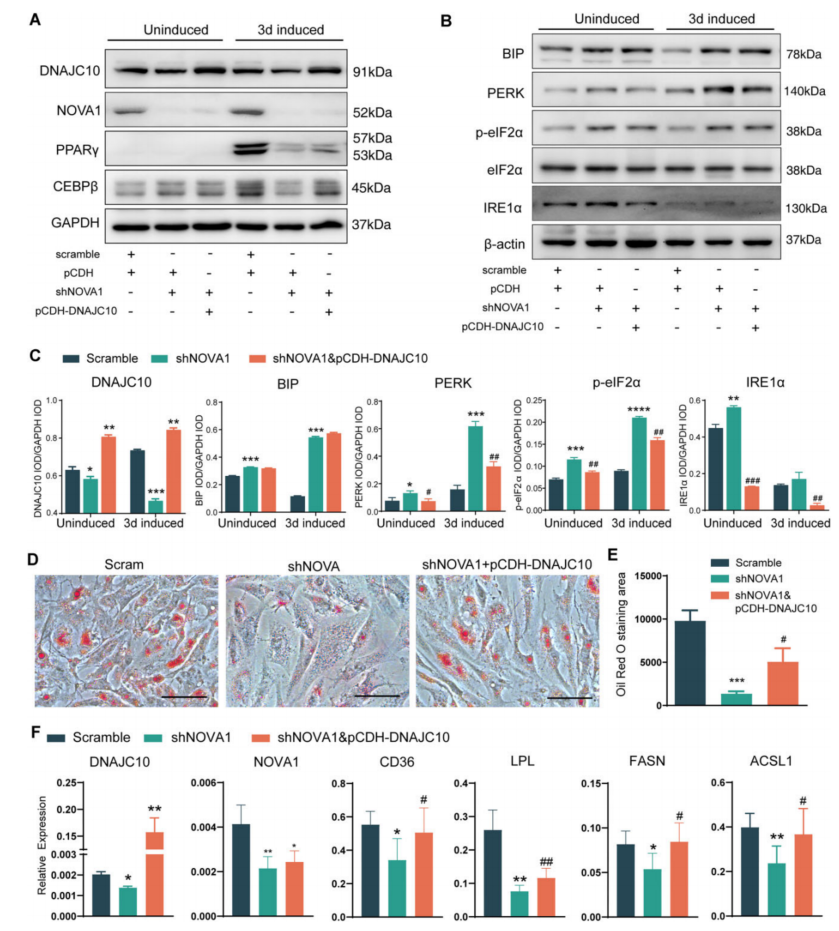
图5 DNAJC10过表达挽救了内质网应激的过度激活和由NOVA1敲低引起的脂肪生成的抑制
5、在hASC脂肪形成过程中,NOVA1通过调节NCOR2的表达和剪接来重塑染色质的可及性
在NOVA1缺失的细胞中,所有三种NCOR2亚型都被上调(图6A)。RNA-seq显示NOVA1敲低细胞的外显子47b剪接数量增加(图6B),敲低改变了NCOR2的剪接模式,增加了47b+异构体的比例(486 bp)(图6C、D)。结果表明,在脂肪形成过程中,NOVA1的上调抑制了脂肪NCOR2的表达,并促进第47b外显子的排除。NCOR2敲低导致hASCs中脂肪生成标志基因的表达水平升高,挽救了NOVA1缺陷诱导的脂肪生成损伤(图6E-G)。因此,结果表明NOVA1调节的NCOR2的表达和剪接参与了hASCs的脂肪生成。
整合ATACseq和RNA-seq数据显示,342个染色质可及性降低和mRNA表达降低的基因在脂肪形成和脂质代谢过程中富集(图6I、J)。NOVA1敲低导致脂质代谢相关基因位点的染色质可及性降低。
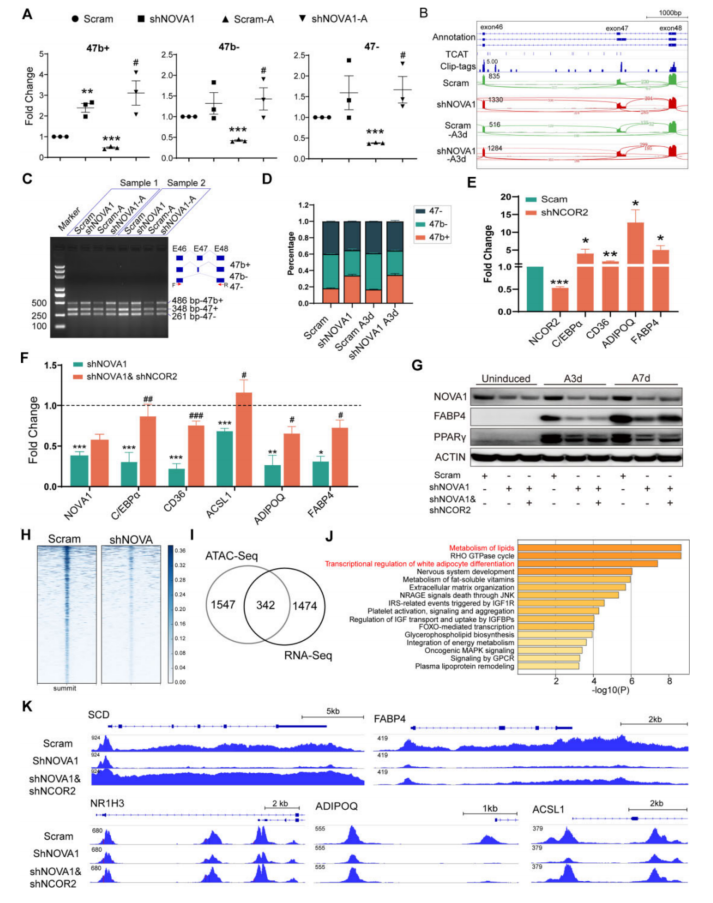
图6 NOVA1-NCOR2相互作用的中断导致染色质可及性的降低
6、NOVA1调控的白色脂肪形成是物种特异性的
建立了Nova1flox/flox小鼠,研究NOVA1在ASC脂肪形成中的体内作用(图7A)。4月龄时的MRI显示,雌性和雄性Nova1-iKO小鼠的各种脂肪库的体积和分布与对照组相似(图7C)。结果表明,Nova1对小鼠白色脂肪组织发育的影响很小。通过重新分析不同小鼠细胞系包括3T3-L1细胞、C3H10T1/2和WAT前脂肪细胞的脂肪形成转录组数据(32-34),证实了这一点(图7G)。在脂肪形成过程中,Nova1缺陷细胞与对照组表现出相同的增加或减少趋势(图7H)。这些结果表明,NOVA1缺乏对mASCs的成脂分化潜力几乎没有影响,提示NOVA1对人和小鼠白色脂肪形成的影响不同。
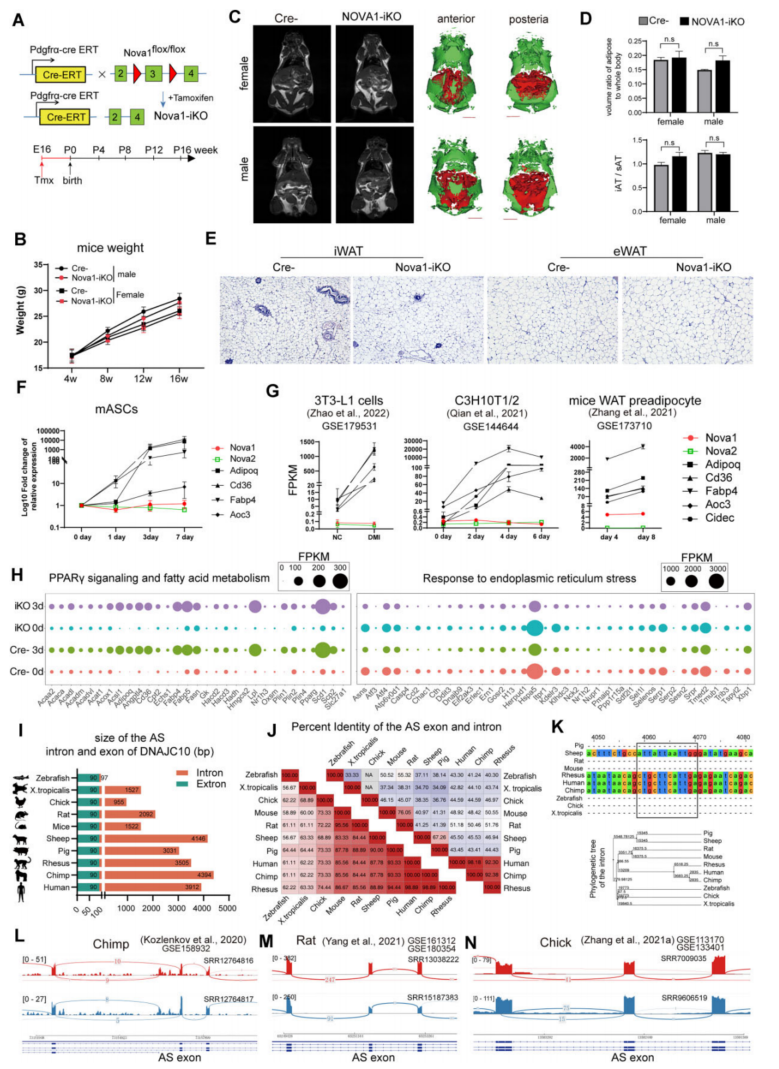
图7 小鼠的白色脂肪形成并不需要Nova1
三、研究结论
RNA结合蛋白NOVA1是人间充质干细胞成脂分化所必需的,NOVA1缺陷导致DNAJC10异常剪接,降低了DNAJC10的表达,并过度激活了未折叠蛋白反应(UPR)。NOVA1敲低导致脂质代谢基因位点染色质可及性降低。NOVA1在白色脂肪形成过程中协调剪接和细胞器功能是人类特异性的。
参考文献:
NOVA1 prevents overactivation of the unfolded protein response and facilitates chromatin access during human white adipogenesis.[J]Nucleic Acids Research, 2023.