| 时间:2024-09-20 |
2024年发表于《International Journal of Biological Sciences》(IF=8.2)
一、研究背景
代谢性相关脂肪性肝病(MAFLD),又称非酒精性脂肪性肝病(NAFLD),是一种多因素诱发的慢性肝病,目前尚无针对MAFLD的批准治疗策略。在MAFLD的发展过程中,STAT3在肝脏中被激活就会磷酸化(P-STAT3),通过P-STAT3的二聚化转运到细胞核,并作为转录因子调节基因表达。
二、研究结果
1、HFD损害糖脂代谢,诱导慢性炎症
图1A为HFD诱导的MAFLD模型。与对照组(CON)相比,HFD组小鼠体重增加(图1B-C)。肝脏体积和肝脏重量/胫骨长比增加(图1B、D),脂滴积累增加(图1E);随机血糖和空腹血糖水平均升高(图1G-H)。OGTT和ITT结果显示HFD诱导糖耐量和胰岛素惯性异常(图1I-J)。肝组织中的典型胰岛素通路保持不变,但HFD导致GLUT4膜运输缺陷(图1K)。HFD组小鼠肝脏中IL-6等活化炎性因子mRNA水平升高,血清中IL-6分泌水平升高(图1L-M)。已知IL-6/STAT3信号通路在许多慢性炎症性疾病中异常高激活。本研究中,STAT3在HFD组的肝组织中被激活(图1N)。这些结果提示肝脏炎症可能在MAFLD的发展过程中被激活。
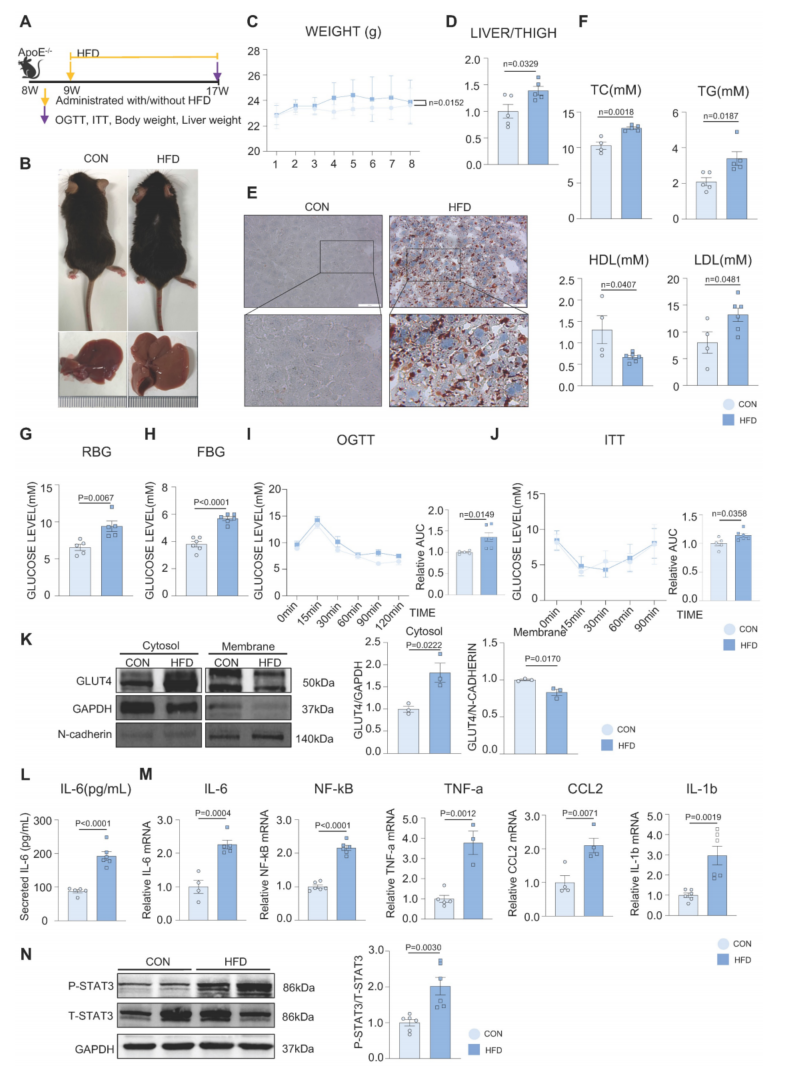
图1 HFD损害糖脂代谢,诱导慢性炎症
2、Ox-LDL在MAFLD的发展过程中诱导了STAT3的激活,导致GLUT4运输缺陷和体外胆固醇积累
体外采用ox-LDL建立了MAFLD模型。ox-LDL抑制胰岛素诱导的GLUT4膜易位,与CON组相比,细胞质中GLUT4较多,膜中GLUT4较少(图2B)。免疫荧光结果也表明GLUT4膜易位缺陷(图2C)。ox-LDL诱导了肝细胞中的胆固醇积累(图2D)。此外,ox-LDL刺激L02细胞IL-6分泌和mRNA均显著增加,并且STAT3也被活化。使用IL-6处理L02细胞后,检测到STAT3的激活,诱导葡萄糖摄取受损和GLUT4膜易位异常,与ox-LDL组相似。使用siRNA敲低STAT3导致胆固醇积累减轻(图2D),STAT3过表达加剧了胆固醇的过度积累(图2E),进一步验证了ox-LDL诱导的肝脏胆固醇紊乱是由于STAT3的激活。
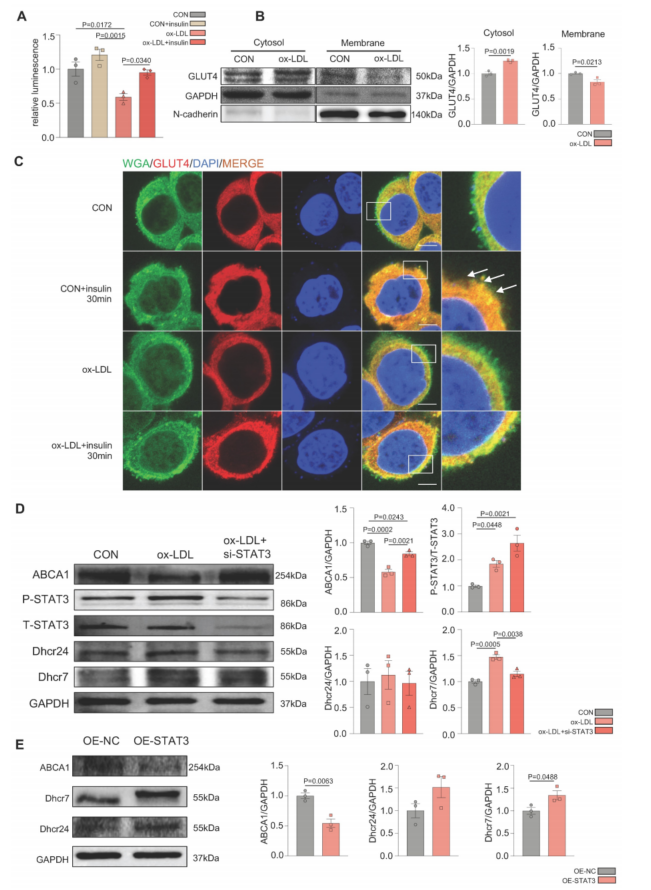
图2 Ox-LDL在MAFLD的发展过程中诱导STAT3的激活,导致GLUT4交通缺陷和体外胆固醇积累
3、VAV3可能参与了STAT3调控的MAFLD的发展
STAT3是一种转录因子,我们在肝组织中进行ChIP-seq,寻找STAT3转录调控的参与调节肝脏糖脂代谢的基因。筛选了63个基因,重点关注糖脂代谢和GLUT4储存囊泡的调节(图3A)。根据ChIP-seq的结果和来自JASPAR数据库的预测,VAV3被发现受STAT3调控,并且根据GO和KEGG数据库,VAV3作为一种GEF蛋白与代谢相关,可以激活Rho gtpase来调节GLUT4的运输。从VAV3的注释峰可以看出,VAV3可能受到STAT3的转录调控(图3E)。根据ChIP-seq和JASPAR数据库,通过WB和IHC验证HFD组肝组织中VAV3表达降低,P-STAT3表达升高(图3F-G)。这些结果表明,VAV3可能受STAT3调控,参与GLUT4易位,促进MAFLD的发生。
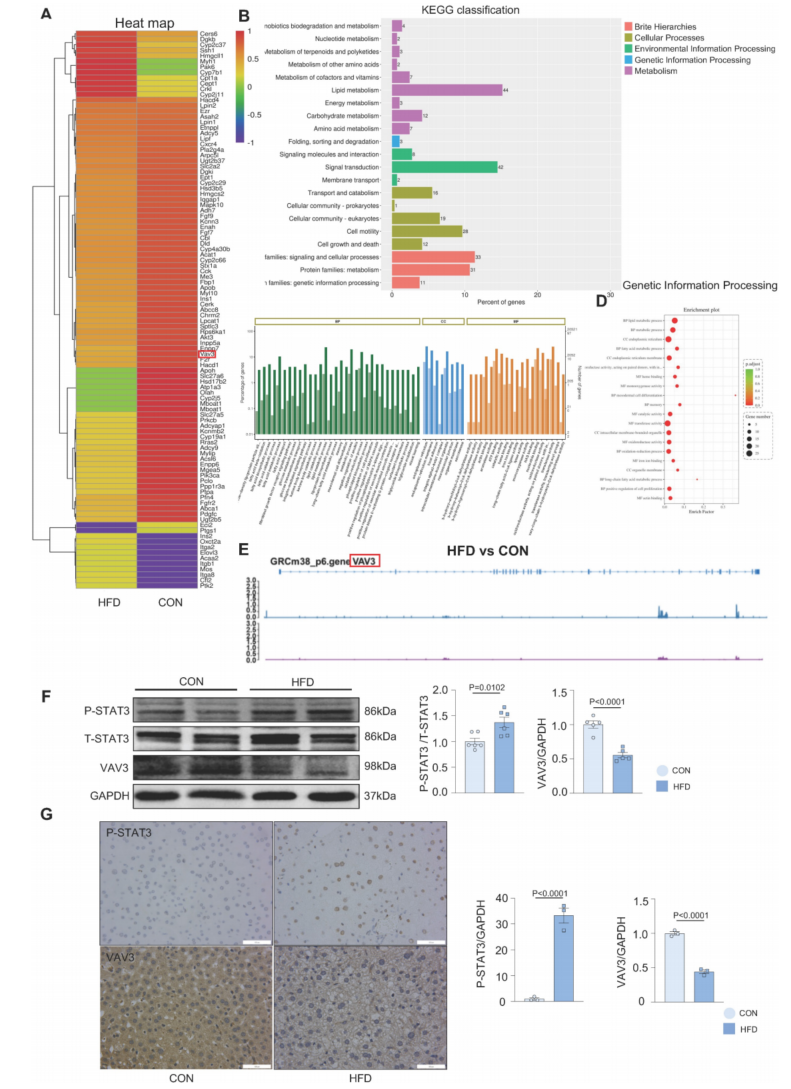
图3 VAV3可能参与了STAT3调控的MAFLD的发展
4、过度激活STAT3可抑制VAV3的表达
根据ChIP-seq分析,探讨STAT3是否通过抑制VAV3的表达来调控MAFLD的发展。敲低STAT3的siRNA以及特异性磷酸化STAT3的抑制剂statstatic对ox-LDL刺激后的L02细胞进行干预。当P-STAT3减少时,VAV3的表达相应增加(图4A-B)。IL-6刺激后,VAV3表达降低,而P-STAT3呈时间依赖性升高(图4C)。此外,siRNA敲低STAT3和过表达STAT3验证了STAT3对VAV3的负调控(图4D-E)。
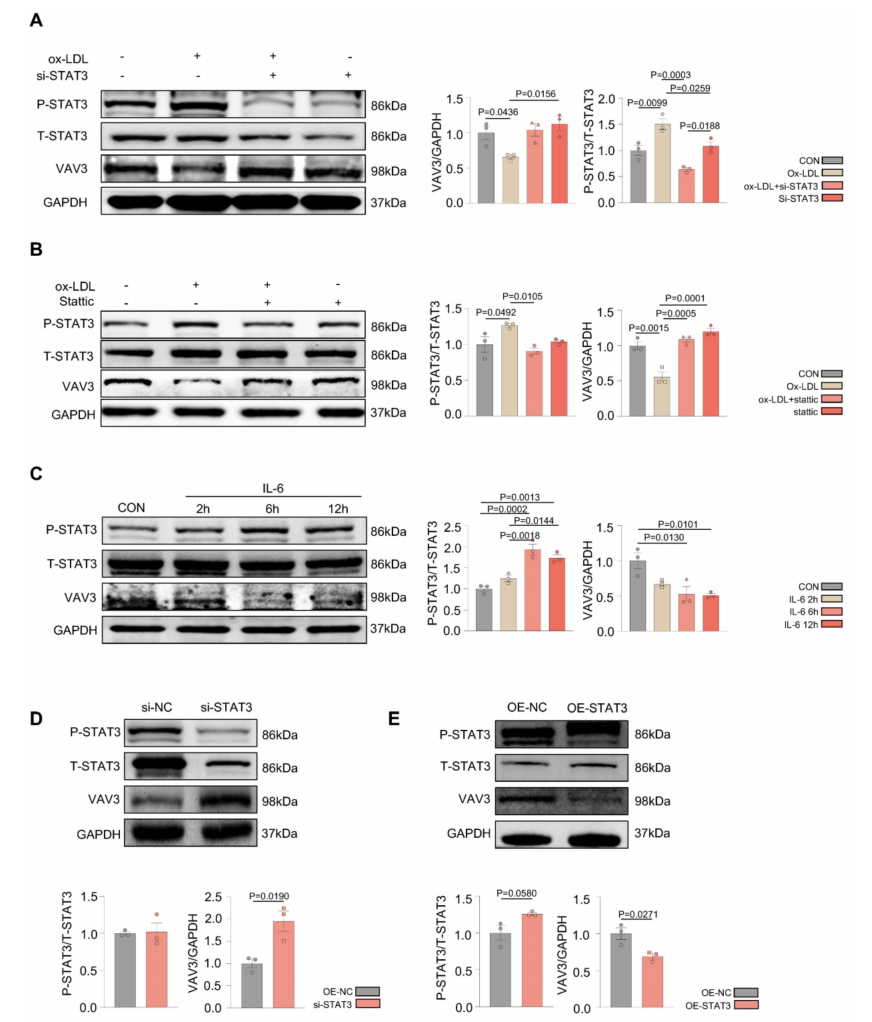
图4 过度激活STAT3可抑制VAV3的表达
5、VAV3缺失可导致GLUT4易位缺陷和胆固醇积累
为了确定VAV3在调节葡萄糖和胆固醇积累中发挥关键作用,使用siRNA和shRNA慢病毒载体敲低VAV3,qPCR和western blotting检测VAV3的敲低效率。观察到由VAV3缺陷引起的GLUT4膜易位缺陷(图5A-C),肝脏VAV3缺乏导致细胞内胆固醇积累(图5D-E)。VAV3缺陷也增加了NF-kB的表达,这可能导致其他细胞损伤,需要进一步探索(图5D)。然而,在ox-LDL刺激下,采用VAV3过表达可减轻细胞内胆固醇积累(图5F-G)。
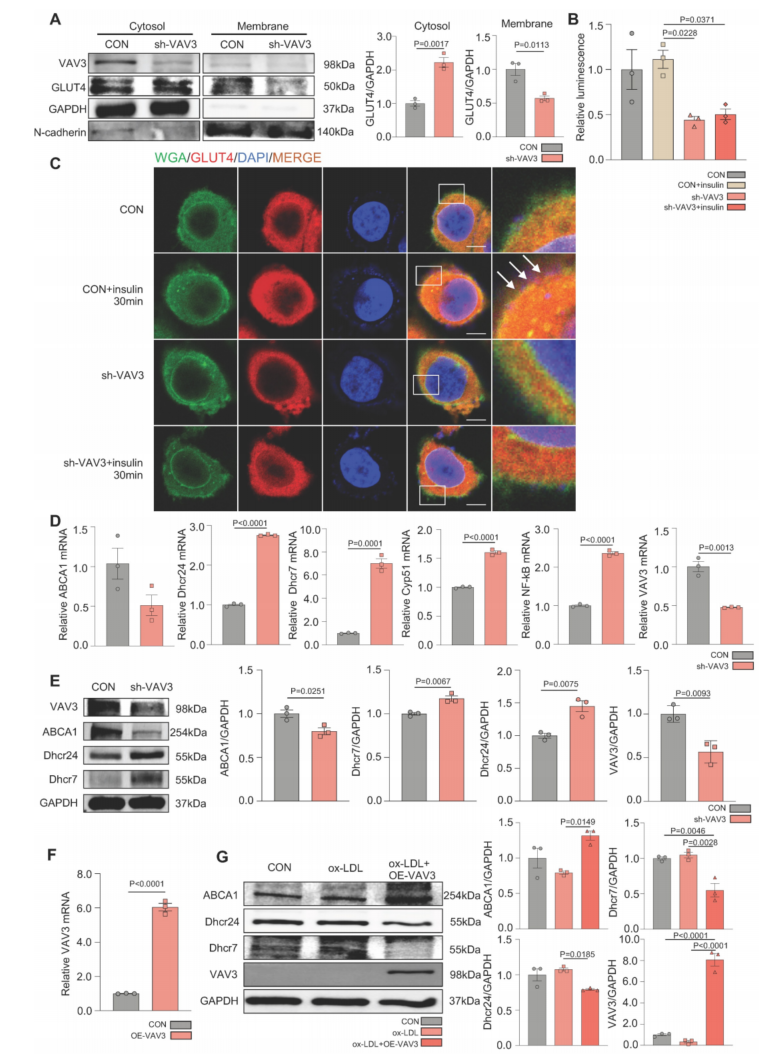
图5 VAV3缺失可导致GLUT4易位缺陷和胆固醇积累
6、恢复VAV3的表达可以减弱MAFLD在体内的发展
建立小鼠MAFLD模型,在AAV组HFD下使用rAAV-TBG-VAV3进行肝脏特异性过表达(图6A)。在12周的喂养期间,随机和空腹血糖水平的测量显示,与HFD组相比,AAV组的糖代谢紊乱有显著改善(图6B-C)。此外,OGTT和ITT结果表明,在HFD下,VAV3的过表达改善了HFD组的葡萄糖稳态和胰岛素敏感性受损(图6D-E)。肝脏过表达VAV3也可以减轻HFD引起的体重和肝脏大小的增加,如体重记录、毛重图片和体重/胫骨长比(补充图6B,图6F-G)。此外,肝脏超声结果证实HFD组存在脂肪性肝病,如蓝色箭头所示,与CON组相比有强光区,而AAV组表现较轻(补充图6C)。与HFD组相比,AAV组血清TG、TC、LDL水平均降低,HDL水平升高,表明VAV3过表达可改善MAFLD的脂质代谢(图6H)。此外,油红O染色显示AAV组的脂滴积累少于HFD组,而免疫组化染色证实AAV组肝脏特异性过表达VAV3(图6I-J,补充图6D)。qPCR和western blotting结果显示,与HFD组相比,AAV组在HFD下VAV3过表达减轻了体内胆固醇在细胞内的积聚(图6K-L)。ELISA结果还显示,AAV组血清IL-6水平低于HFD组,qPCR提示AAV可通过恢复HFD下VAV3的表达来抑制肝组织中多种炎症因子(图6M-N)。综上所述,恢复肝脏中VAV3的表达不仅可以减少糖脂异常,还可以抑制肝脏炎症,最终改善MAFLD的发展。
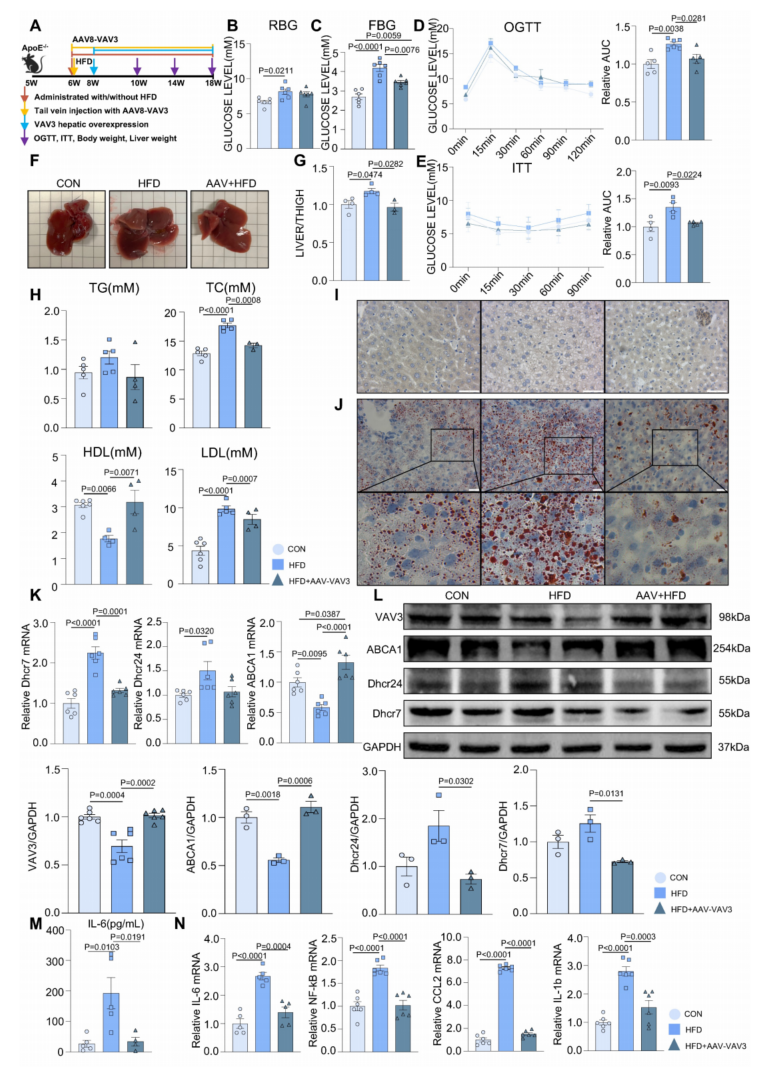
图6 恢复VAV3的表达可以减弱MAFLD在体内的发展
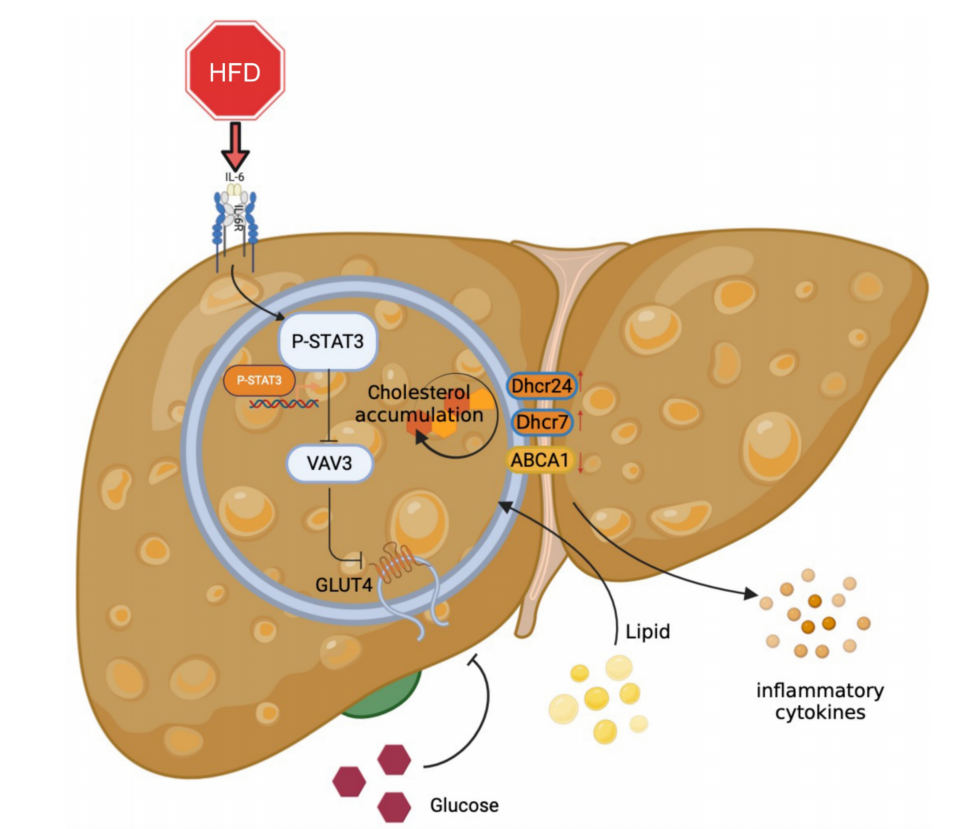
图7 STAT3/VAV3轴参与的MAFLD的发展机制
三、研究结论
STAT3/VAV3信号通路可能通过调节葡萄糖和胆固醇代谢在MAFLD中发挥重要作用,VAV3可能是一种潜在的治疗策略,从而改善MAFLD。
参考文献:
The role of STAT3/VAV3 in glucolipid metabolism during the development of HFD-induced MAFLD.[J]International Journal of Biological Sciences, 2024.