| 时间:2024-09-13 |
2023年发表于《Advanced Science》(IF=14.3)
研究思路:
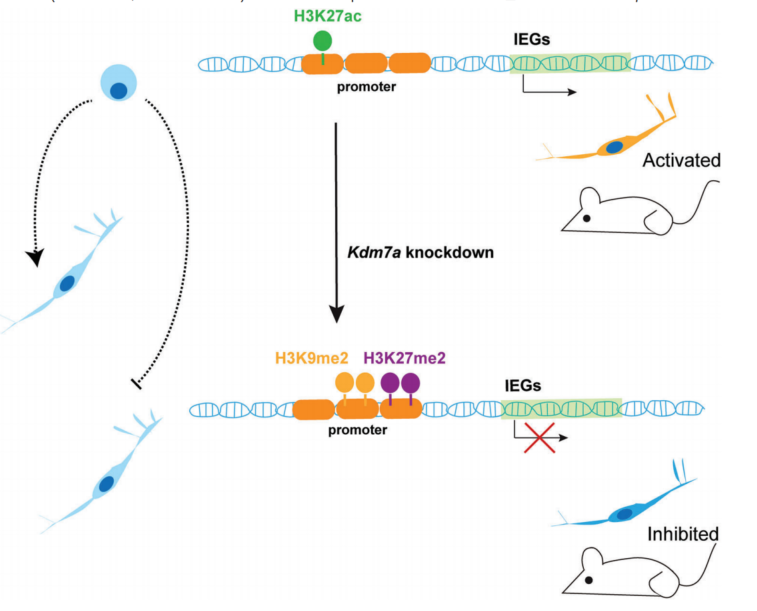
KDM7A调节小鼠神经元中的IEGs的模型
一、研究背景
中枢神经系统的神经元丧失会导致认知功能障碍,产生神经退行性疾病。组蛋白去乙酰化酶(HDAC)作为治疗神经退行性疾病的潜在靶点已经研究了很长时间,因此迫切需要寻找新的表观遗传靶点。KDM7家族由三个成员组成:KIAA1718(KDM7A),PHF8(KDM7B)和PHF2(KDM7C)。作为一种去甲基化酶,KDM7A主要负责去除组蛋白上的H3K9me1/2和H3K27me1/2;KDM7A在哺乳动物神经系统中的调控机制尚不清楚。即时早期基因(Immediate early genes,简称IEGs)在外界刺激下快速而短暂地表达,因此,它们被广泛用作神经元活动的标记物。
二、研究结果
1、KDM7A在神经元细胞分化过程中表达增加
Neuro-2a(N2a)是一种小鼠神经嵴来源的细胞系,作为体外模型。诱导N2a细胞分化,细胞体直径1.5倍的细胞定义为分化细胞(图1b)。诱导4天后,KDM7A表达在N2a分化过程中呈时间依赖性增加(图1c)。分化后,KDM7A在mRNA和蛋白水平上的表达均显著增加(图1c-e)。在N2a分化过程中,发现Mtap2和Syp)以时间依赖的方式增加(图1f,g),表明诱导系统成功。因此,在随后的分析中,Mtap2和Syp被用来评估N2a细胞的分化进程。

图1 KDM7A在神经元细胞分化过程中增加
2、KDM7A是神经元细胞分化的关键因素
为了评估KDM7A在N2a分化中的作用,用两种shRNA慢病毒敲低了Kdm7a。在mRNA和蛋白水平上检测了敲低效率(图2a-c)。shKdm7a N2a细胞的分化率明显降低(图2g)。Mtap2和Syp mRNA水平在shKDM7A N2a细胞中也降低(图2h),提示shKdm7a抑制了N2a细胞的分化。过表达Kdm7a(图2i),发现N2a细胞的分化明显促进(图2j-1)。这些结果提示KDM7A在神经元细胞分化中的重要作用。神经元标记物Tuj-1免疫荧光染色显示,对照组标记细胞开始向皮层迁移分化,而敲低组细胞在脑室壁(图2n、o)。这突出了KDM7A在体内神经元细胞分化中的关键作用。

图2 KDM7A促进神经元细胞分化
3、KDM7A介导基因表达的潜在机制
ChIP-seq和CUT&Tag检测到KDM7A结合富集的相似区域(图3a)。两种CUT&Tag抗体检测到的一致峰,其中55.5%位于启动子上(图3b)。KDM7A与启动子结合的基因的表达水平明显高于其他基因(图3c)。KDM7A结合基序(图3d)中前10位基序中有5个序列相似,可与c-Jun、Fra2、Fra1、JunB和Atf3结合,均属于AP-1家族。
KDM7A是一种组蛋白去甲基化酶,可特异性地消除H3K9和H3K27的二甲基化,使用ChIP-seq和CUT&Tag检测Kdm7a敲低后TSS上六种组蛋白修饰的变化。结果表明,当Kdm7a敲低时,TSS时一些抑制性组蛋白修饰增加,活性组蛋白修饰减少,这可能有助于靶基因的调控。
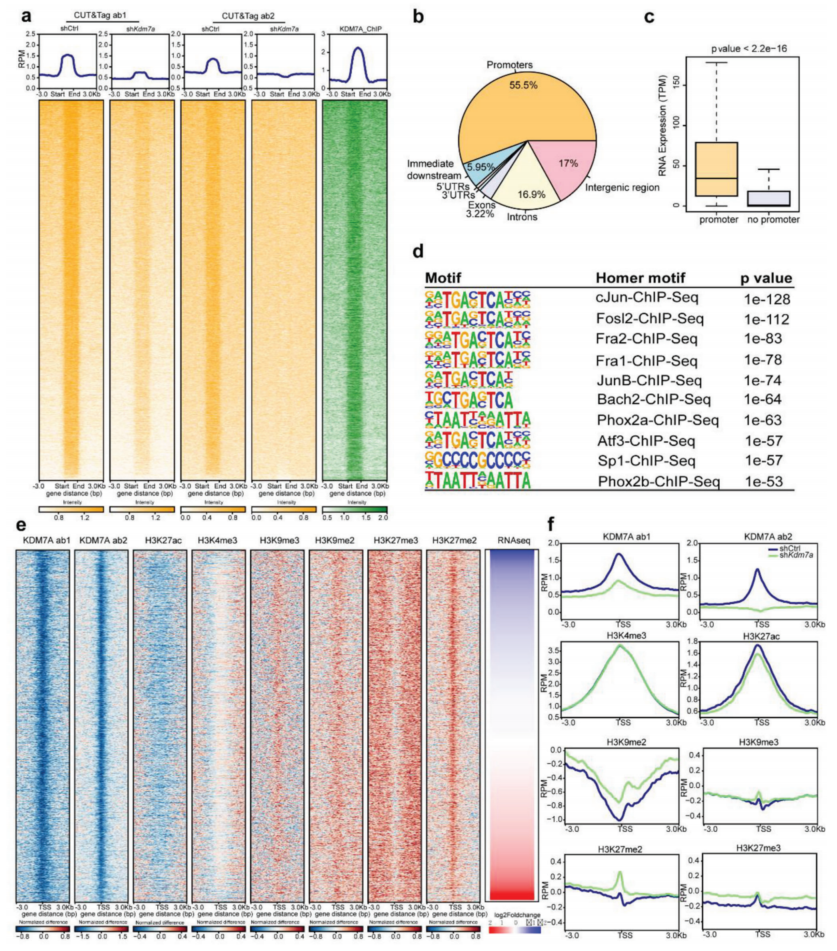
图3 全基因组KDM7A结合及其对组蛋白修饰的影响
对shCtrl和shKdm7a N2a细胞进行RNA-seq分析。Kdm7a敲低后,差异基因主要富集于表达调控(图4c)。将DEG与启动子与KDM7A结合的基因整合。结果显示与KDM7A结合相关的上调和下调基因数量几乎相同(图4d、e),这表明KDM7A对基因调控的机制很复杂。差异基因的结合基序(图4f、g)分析显示,上调基因的顶部基序是抑制性转录因子Thap11,下调基因的顶部基序是活性转录因子Sp1。KDM7A峰位于Egr1和Atf3的启动子区。Kdm7a敲低使H3K9me2、H3K9me3、H3K27me2和H3K27me3水平升高,而在Egr1和Atf3的TSS处H3K27ac水平降低。过表达Kdm7a,不同程度的激活了这些IEGs(图41)。这些结果表明KDM7A可能通过调节TSS抑制或激活组蛋白修饰来介导IEG的表达。同时KDM7A可能与不同的TF协同激活或抑制其靶基因。

图4 KDM7A调控靶基因的表达
4、海马神经元中Kdm7a基因敲低会影响小鼠的认知和情绪行为
为研究小鼠大脑中KDM7A表达的改变是否会影响小鼠的认知和情绪行为。KDM7A在海马中的表达最高(图5a)。基于scRNA-seq数据集,发现Kdm7a在颗粒细胞(一种神经元)中的表达水平高于其他任何细胞类型(图5b,c)。小鼠脑切片中共免疫荧光检测结果显示,KDM7A主要在Tuj-1标记的神经元中表达(图5e),这与scRNA-seq数据一致。通过神经元特异性腺相关病毒(AAV)立体定向注射敲除小鼠海马神经元中的Kdm7a(图5f,g),成功敲除海马神经元中Kdm7a的表达(图5h-j)。

图5 小鼠大脑中Kdm7a的敲除
注射AAV后21 d进行行为学测试。与假小鼠相比,shKdm7a小鼠对探索新物体的兴趣较低,(图6f、g),这表明短期记忆形成存在缺陷。海马区IEGs下调(图6h),这与体外实验数据相关。c-Fos是研究最多的IEG,被广泛用作神经元活动的标记物。c-fos在shKdm7a小鼠的CA1区表达明显降低(图6i,j),这表明Kdm7a基因敲除后,神经元活性下降。

图6 KDM7A影响小鼠的神经元功能
三、研究结论
赖氨酸去甲基化酶KDM7A去除组蛋白修饰H3K9me1/2和H3K27me1/2,并可能与转录因子(TF)协同调节关键IEGs(如Egr1和Atf3)的表达。KDM7A的缺失会影响神经元细胞分化和小鼠神经元活动,导致情绪和记忆障碍。这可能为理解神经系统疾病的表观遗传机制提供新的线索。
参考文献:
The Lysine Demethylase KDM7A Regulates Immediate Early Genes in Neurons.[J]Advanced Science, 2023.