| 时间:2024-08-23 |
2023年发表于《Clinical and Translational Medicine》(IF=7.9)
一、研究背景
乳腺癌(BC)是最常见的肿瘤,分为四种亚型:A型、B型、HER2富集型和三阴性乳腺癌(TNBC)。TNBC患者预后最差,深入研究TNBC的潜在分子机制并制定新的治疗策略至关重要。IGF2BP3,又称IMP3,IGF2BP3在BC中参与多种关键的生物学通路。IGF2BP3作为m6A的关键结合蛋白(Reader),通常通过依赖m6A的方式介导mRNA的稳定,但IGF2BP3在三阴性乳腺癌(TNBC)肿瘤发生中的潜在机制尚不清楚。
二、研究结果
1、调控TNBC的增殖和凋亡
为了确定不同BC亚型之间独特的分子特征,分析TCGA数据集发现,在8个m6A“Reader”中,TNBC样本中的IGF2BP3mRNA水平明显高于非TNBC样本和正常组织(图1A-C)我们对TNBC和非TNBC之间的TCGA数据集进行了基因表达差异的综合分析。qRTPCR(图1E)和western blotting(图1F)也证实了这一结果。TNBC的Kaplan-Meier生存曲线显示,高表达的IGF2BP3与TNBC患者的不良OS之间存在显著相关性(图1G),说明IGF2BP3可能是TNBC的预后标志物。
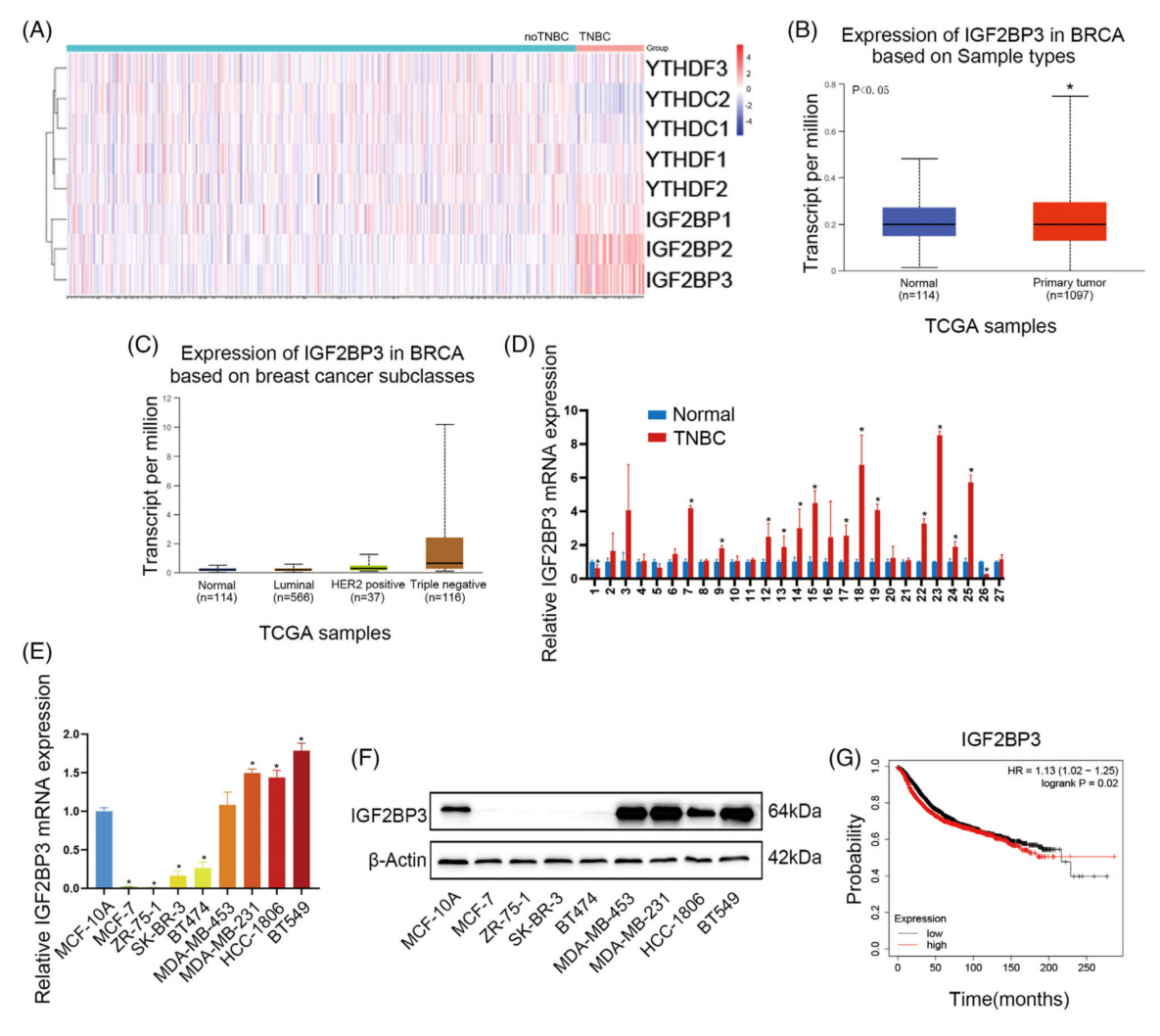
图1 IGF2BP3在三阴性乳腺癌(TNBC)中表达上调,并与不良预后相关
2、IGF2BP3的启动子在TNBC中低甲基化
IGF2BP3的表达是由其启动子的DNA甲基化状态和转录活性介导的。与非TNBC组织相比,TNBC组织中IGF2BP3及启动子甲基化水平下调(图2B、C)。
为了探索DNA去甲基化酶在TNBC中调节IGF2BP3启动子甲基化水平的潜在作用,在MDA-MB-231和HCC-1806细胞系中使用特异性siRNA敲除DNMT1/3A/3B和TET1/2/3。发现只敲低TET3,会导致IGF2BP3表达降低(图2D-F)。TNBC患者组织中,IGF2BP3与TET3呈正相关。ChIP-qPCR实验证明TET3可以结合到IGF2BP3启动子区域。MSP分析表明,TET3的敲低部分增加了IGF2BP3启动子的甲基化水平(图2G)。结果表明,TNBC中IGF2BP3的高表达与其启动子的低甲基化有关,而TET3导致IGF2BP3启动子去甲基化。
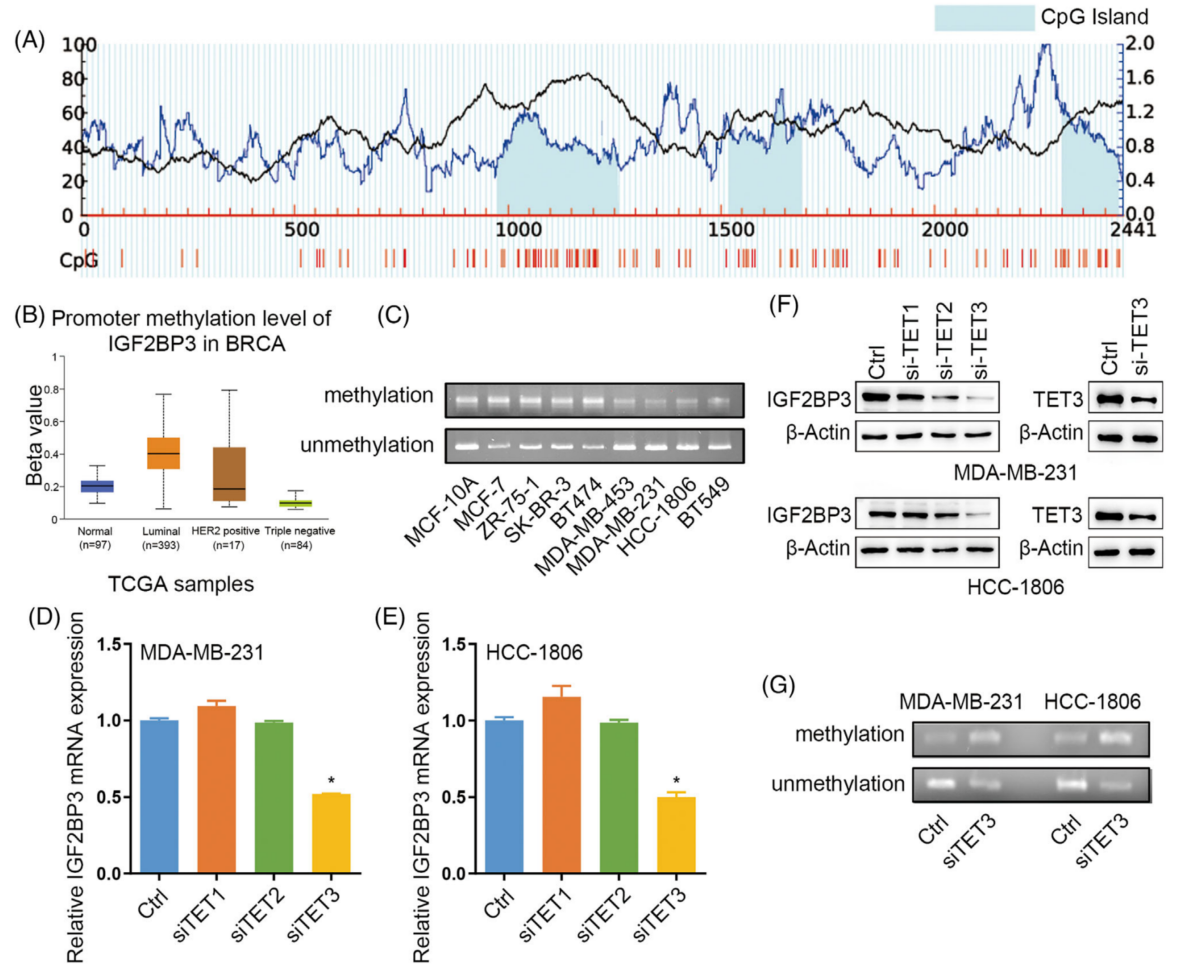
图2 IGF2BP3的启动子在三阴性乳腺癌(TNBC)中被低甲基化
3、敲除IGF2BP3可抑制体内外TNBC的增殖,促进细胞凋亡
为了研究IGF2BP3在TNBC细胞中的作用,MDA-MB-231和HCC-1806细胞中敲低IGF2BP3,通过qRT-PCR和western blot验证IGF2BP3的转染效率(图3A,B)。IGF2BP3敲低可降低细胞增殖(图3C-H),早期和晚期凋亡细胞均显著增加(图3I)。IGF2BP3下调后,参与细胞凋亡形态学和生化变化的cleaved-caspase 3和caspase 9的表达增加(图3J)。在异种移植物模型中,IGF2BP3敲低组的肿瘤体积增长速度比对照组慢(图3K)。4周后,IGF2BP3敲低组的肿瘤体积和重量均低于对照组(图3L,M),表明IGF2BP3敲低抑制了体内肿瘤的增殖。同时,体外证明过表达IGF2BP3刺激TNBC增殖,抑制细胞凋亡。
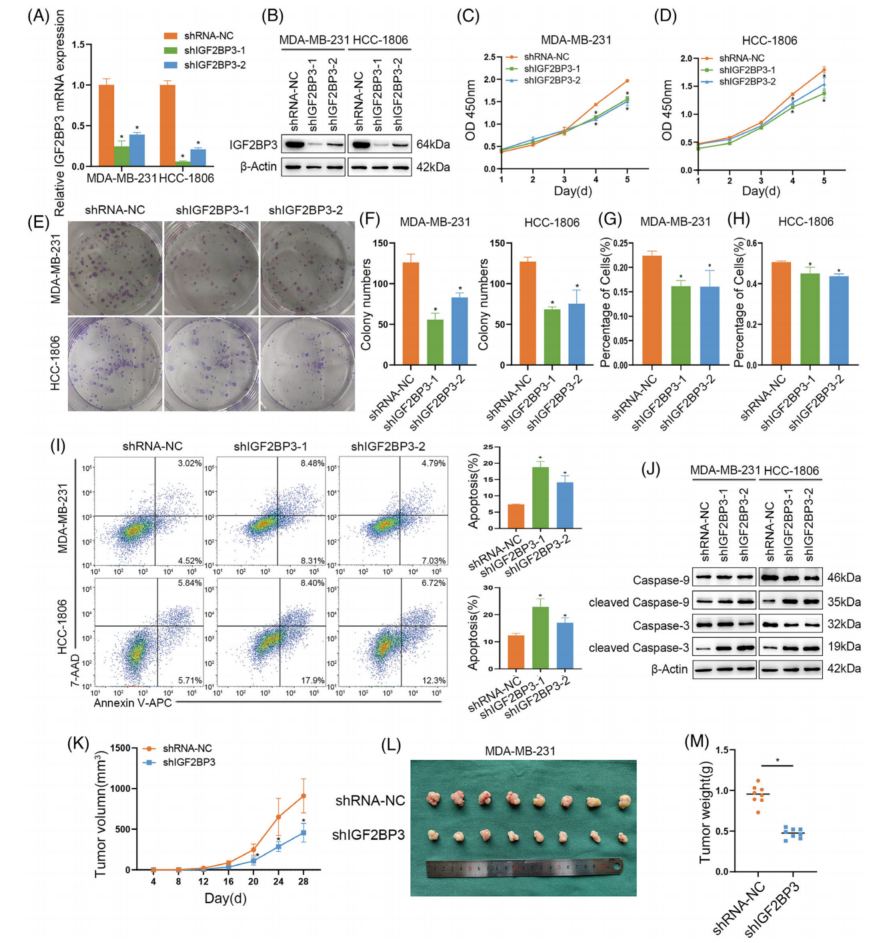
图3 在体内和体外,敲低IGF2BP3可抑制三阴性乳腺癌(TNBC)的增殖,促进细胞凋亡
4、TNBC中IGF2BP3靶点的分析
为了揭示IGF2BP3在TNBC中的潜在机制,对IGF2BP3敲低和对照组MDA-MB-231细胞进行了RNA-seq分析。GO分析表明,IGF2BP3调控的DEGs与细胞周期、自噬、转化生长因子-β和肿瘤坏死因子信号通路有关(图4B)。GSEA还显示IGF2BP3的DEGs与外源性凋亡和内源性信号通路、RNA分解代谢过程和mRNA代谢过程的调控有关(图4C-F),提示IGF2BP3可能在TNBC中发挥致癌作用。MeRIP-seq分析发现26904个m6A峰对应10939个基因。这些m6A峰主要富集在CDS区域(图4G、H)。
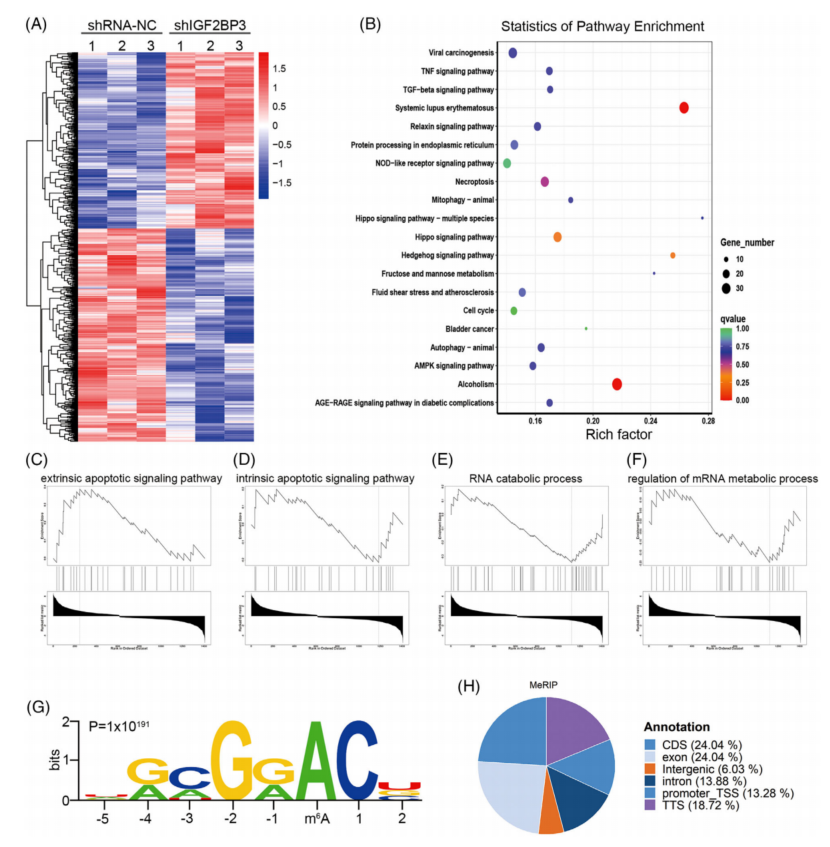
图4 三阴性乳腺癌(TNBC)中IGF2BP3靶点的鉴定
5、NF1是TNBC中IGF2BP3的m6A靶点
通过将这些来自RIP-seq、RNA-seq和MeRIP-seq的基因重叠,得到了129个由IGF2BP3结合并被m6A修饰的基因(图5A)。通过DAVID(https://david.ncifcrf.gov)对KEGG通路进行分析,鉴定出三个候选基因(NF1、BCL2和GSK3B),它们都与细胞凋亡有关。通过qRT-PCR评估,BCL2和GSK3B在IGF2BP3敲低或过表达细胞中几乎没有变化,选择了NF1。NF1中大多数IGF2BP3结合位点与m6A修饰位点吻合良好(图5B),qRT-PCR和western blot分析表明NF1可能是IGF2BP3的潜在靶点(图5C-E)。图5F显示,TNBC患者组织中,IGF2BP3与NF1表达呈负相关。Kaplan-Meier生存曲线显示TNBC较低的NF1表达与TNBC患者的不良OS相关(图5G)。
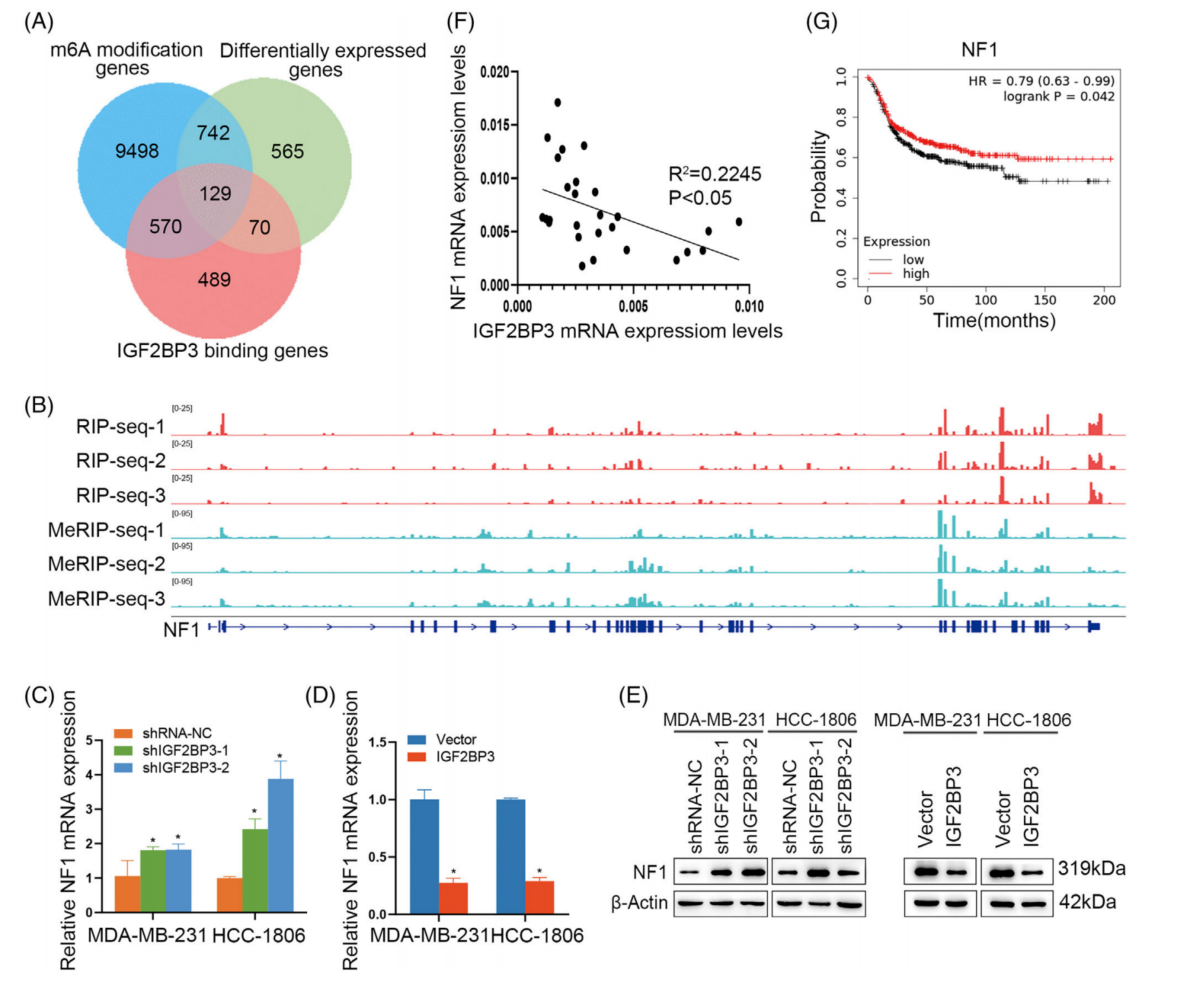
图5 在三阴性乳腺癌(TNBC)中,NF1是IGF2BP3的m6A靶点
6、IGF2BP3通过m6a依赖的方式调控NF1 mRNA的表达
为了研究IGF2BP3对NF1表达的调节作用,将IGF2BP3敲低和过表达的MDA-MB-231细胞在不同时间点用5μg/mL ActD孵育。发现IGF2BP3表达下调会延长NF1 mRNA的半衰期(图6A),IGF2BP3过表达会降低NF1 mRNA的半衰期(图6B)。证实IGF2BP3可以通过调节mRNA的稳定性来降低NF1的表达。
MeRIP和RIP分析结果显示NF1可以结合到m6A位点(图6G,H)。为了确定IGF2BP3是否通过m6依赖的方式调节NF1的表达,进行了双荧光素酶实验,以确定IGF2BP3与NF1 mRNA结合所必需的m6A位点。携带NF1-B和C的荧光素酶报告蛋白的活性因IGF2BP3的下调而降低。与对照组相比,携带NF1-B-mut和C-mut的荧光素酶报告蛋白活性降低(图6L-N)。这些结果表明IGF2BP3可以通过m6A依赖的方式直接连接到NF1 mRNA的NF1- b和C位点,从而降低NF1的表达,这表明m6A特异性修饰位点位于5291、5450和7587碱基。
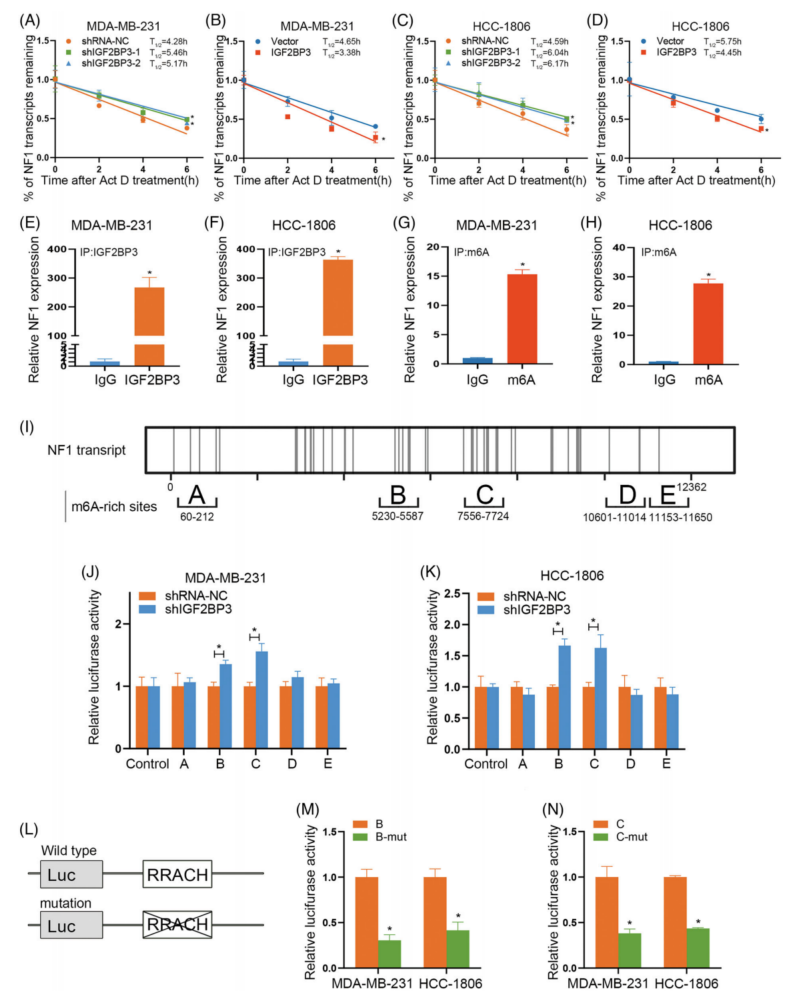
图6 IGF2BP3通过n6-甲基腺苷(m6a)依赖的方式调节神经纤维蛋白1(NF1)mRNA的表达
7、NF1逆转了IGF2BP3下调诱导的增殖抑制和凋亡促进
用siRNA感染IGF2BP3敲低组和对照组MDA-MB-231和HCC-1806细胞,抑制NF1的表达。通过qRT-PCR和western blotting验证转染效率(图7A、B)。NF1抑制组在MDA-MB-231和HCC-1806细胞中的增殖能力增强,而IGF2BP3的敲低使增殖能力下降(图7C-F)。NF1的下调增加了cleaved-caspase 3和9的表达(图7B)。在异种移植模型中,shRNA-NC组和shIGF2BP3组中NF1抑制组的肿瘤体积比对照组增大得更快(图7I、J),对照组肿瘤重量也出现了同样的结果(图7K)。这些结果证实NF1可以逆转IGF2BP3敲低对细胞增殖的抑制,促进细胞凋亡。
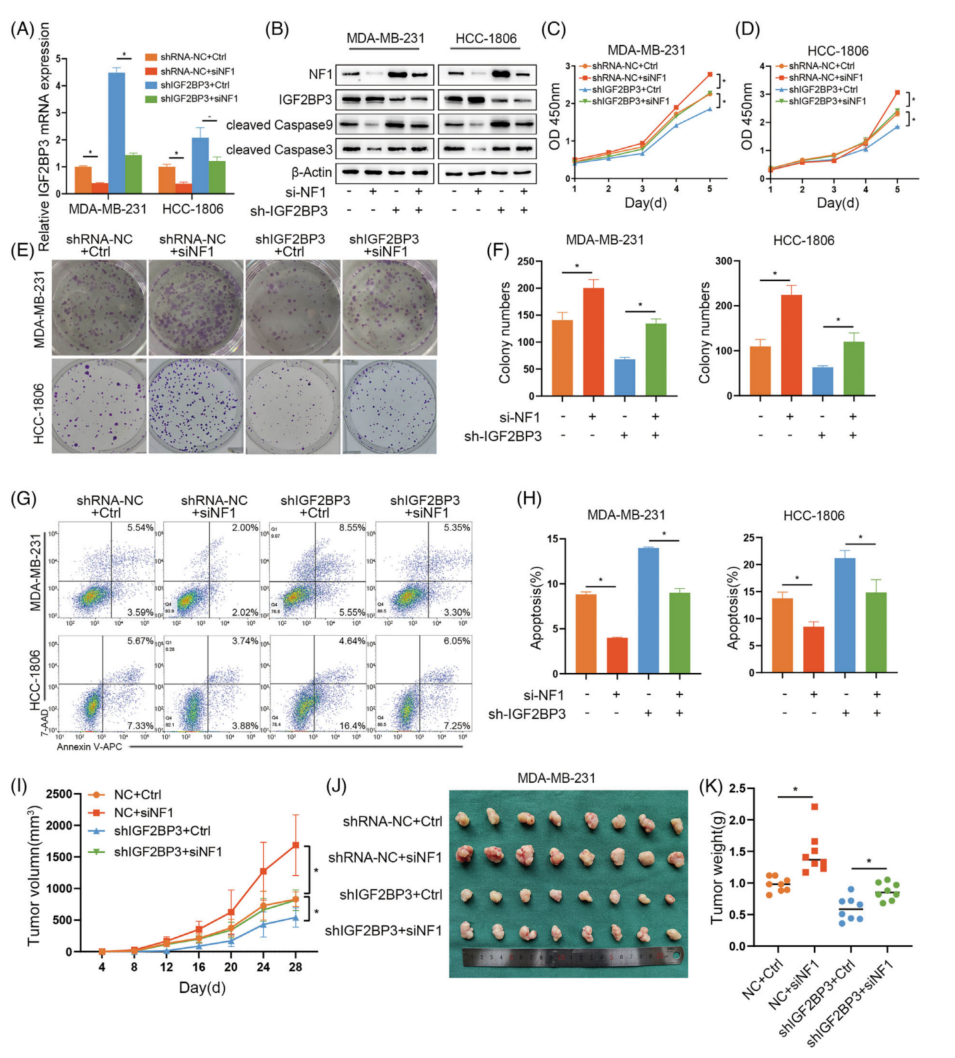
图7 神经纤维蛋白1(NF1)逆转了抑制IGF2BP3诱导的细胞增殖和促进凋亡的作用
三、研究结论
TET3介导的IGF2BP3通过m6a依赖的方式破坏NF1 mRNA的稳定性,从而加速TNBC的增殖。这表明IGF2BP3可能是TNBC的潜在治疗靶点。
参考文献:
IGF2BP3 mediates the mRNA degradation of NF1 to promote triple-negative breast cancer progression via an m6A-dependent manner.[J]Clinical and Translational Medicine, 2023.