| 时间:2024-08-09 |
2024年发表于《mSystems》(IF =5.0)
一、研究背景
克罗恩病(CD)是一种慢性炎症性肠病,肠道微生物群在CD的发病机制中起着重要作用。与健康患者相比,CD患者的微生物群落多样性较低。miRNA是一类小的非编码RNA,可对靶向基因表达进行调控。在肠道内,宿主miRNA主要由肠上皮细胞分泌,然后释放到管腔中,通过调节肠道微生物群的生长和组成,严重影响CD病理生理。同时,宿主肠道内的肠道微生物群可以调节miRNA的表达。肠道微生物和miRNA在不同阶段的关系尚不清楚。
二、研究结果
1、CD患者组和对照组的临床特征
aCD组是诱导治疗前PCDAI≥10分的样本,rCD是诱导治疗后PCDAI<10分的样本,aCDs是诱导治疗前的rCD,Ctr是健康对照。诱导治疗后,27例患者中有11例达到临床缓解(rCD)。
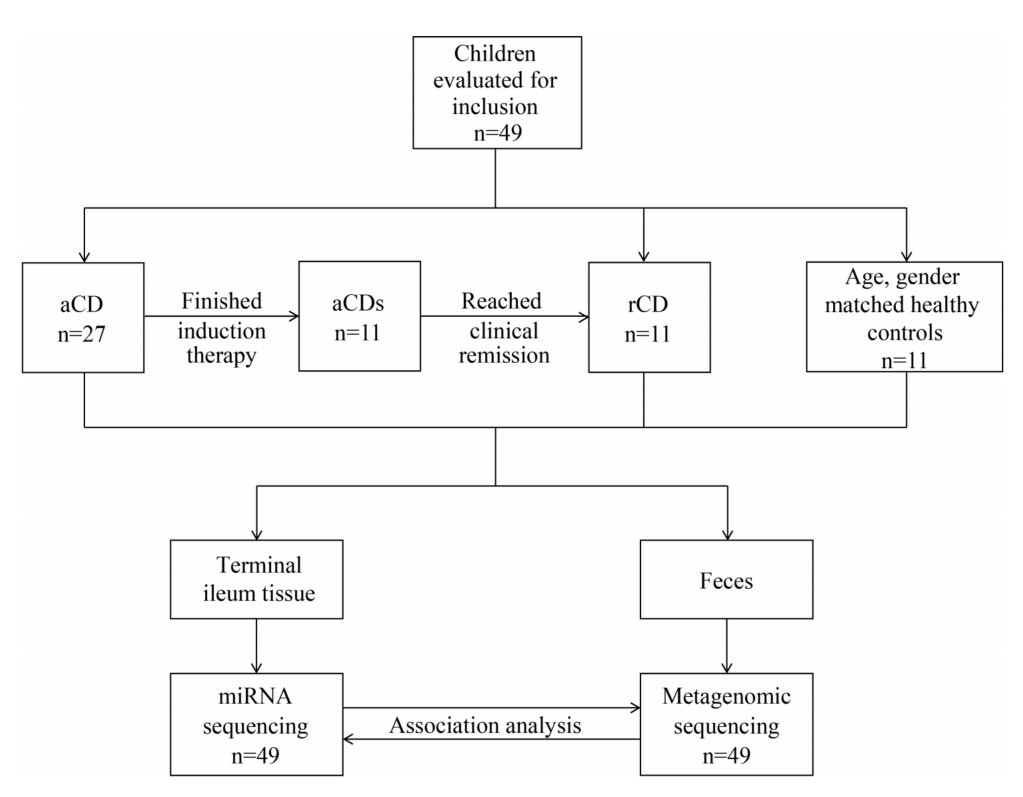
图1 实验设计工作流程:患者招募、样本采集及检查
2、诱导治疗改善了乳糜泻患者的肠道生态失调
比较aCD患者和Ctr之间,以及aCD患者和缓解期患者(rCD)之间的肠道微生物。Firmicutes是Ctr组和rCD组中最占优势的门。aCD组和aCDs组中,Proteobacteria是最优势的微生物(图1A和B)。发现Ctr的肠道菌群α-多样性高于aCD组,rCD组的α-多样性高于aCD组。β多样性的PCoA分析显示了GM结构两类群在种和门水平上均明显分离(图2D和F)。
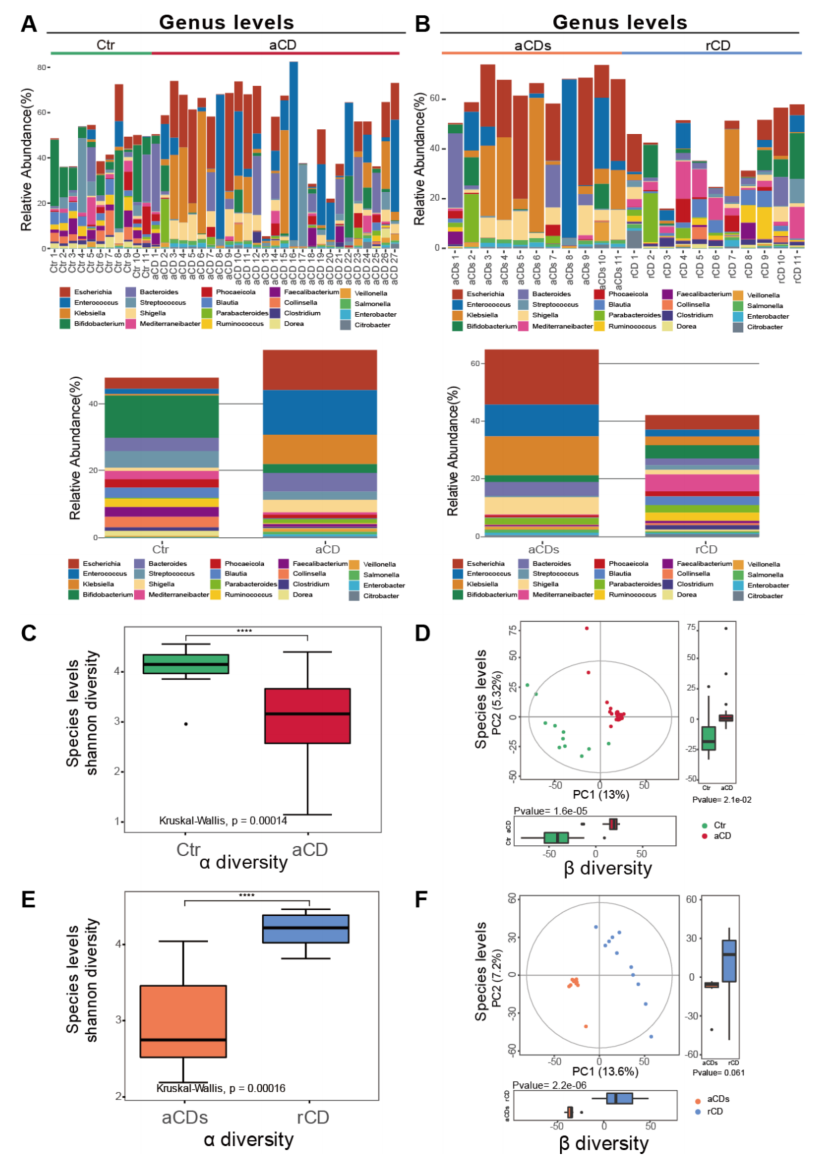
图2 四组中肠道微生物的差异
3、CD患者中有7个关键微生物发生了显著变化
四组之间肠道微生物的显著差异如图3A和B所示。与Ctr组相比,aCD组有392个微生物水平升高,2845个微生物水平降低(图3A);与aCDs组相比,rCD组758个微生物水平增加,50个微生物水平降低(图3B);并筛选出7个发生显著变化的关键微生物。为了进一步评估改变的GM谱是否与疾病严重程度相关,检查了它们与PCDAI、CDEIS评分和钙保护蛋白的相关性,发现156种微生物与PCDAI、CDEIS评分和钙保护蛋白密切相关。
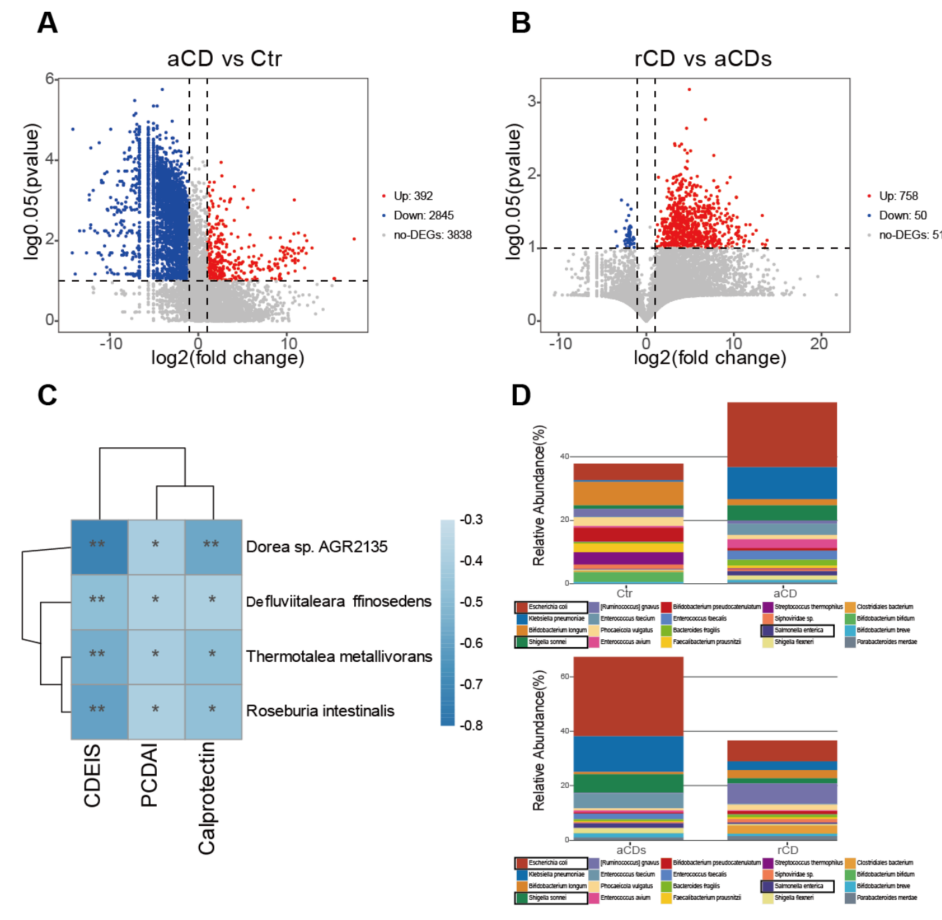
图3 四组中的关键肠道微生物
对7个关键微生物水平进行RT-qPCR验证,如图4A-G所示,与Ctr组相比,aCD组的D. raffinosedens、T. metallivorans、R. intestinalis和Dorea sp. AGR2135的比例在缓解后有所降低,而rCD组则有所增加。同时,E. coli、S. sonnei和S. enterica的比例在CD患者中呈先升高后降低的趋势。这与宏基因组测序结果数据一致。
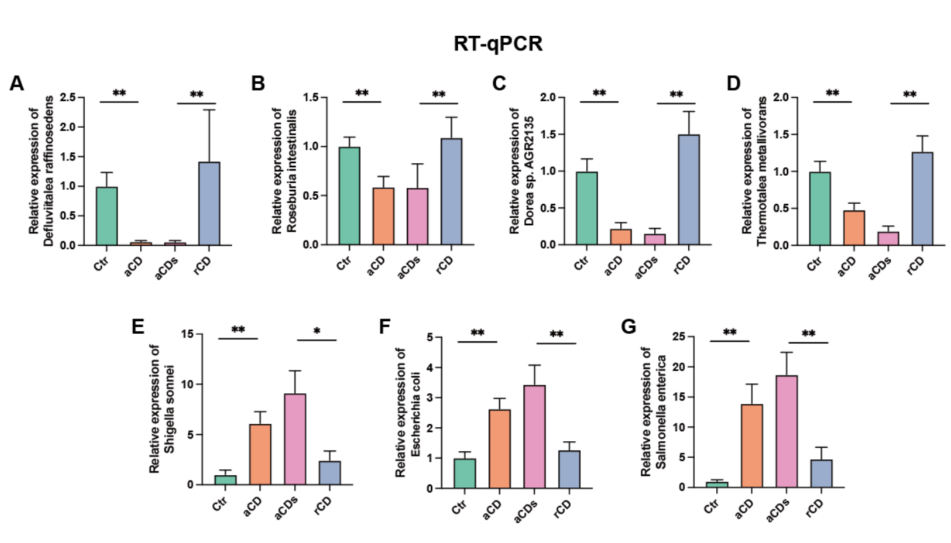
图4 7种微生物的相对组成
4、CD患者的miRNA谱发生了改变
分析CD患者诱导治疗前后回肠末端组织miRNA谱,并与Ctr进行比较。图5A列出了四组中丰度最高的前20个miRNAs。筛选到的两个关键miRNAs hsa-miR-215-5p和hsa-miR-194-5p在四组间的相对表达量见图5D、E。
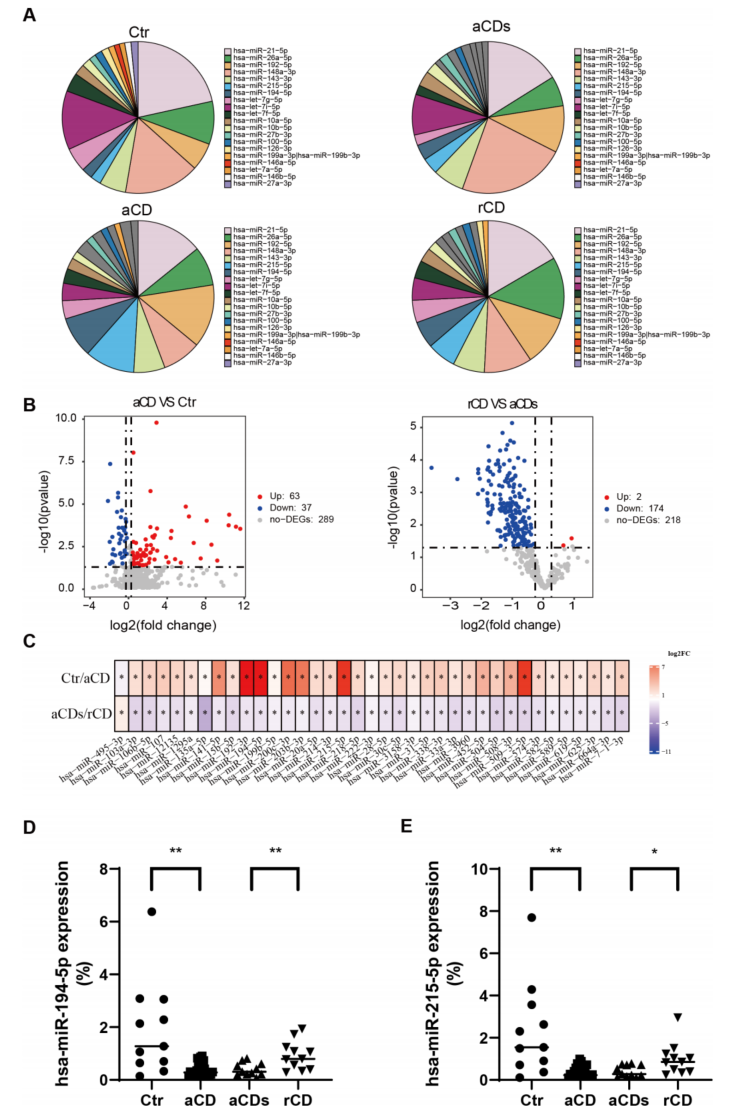
图5 在四组中发现了差异miRNA谱和两个关键miRNAs
5、差异表达的miRNAs及其功能分析
为了进一步估计miRNA谱的改变是否与CD疾病状态、回肠末粘膜状态和回肠末炎症有关,研究了miRNA谱与PCDAI、CDEIS评分和钙保护蛋白的相关性。发现hsa-miR-12135和hsa-miR-509-3-5p的表达与PCDAI、CDEIS评分和钙保护蛋白呈负相关;hsa-miR-212-5p、hsa-miR-4448、hsa-miR-501-3p和hsa-miR-503-5p的表达与PCDAI、CDEIS评分和钙保护蛋白呈正相关(图6A)。对8个关键miRNAs进行富集分析,GO分析显示富集于细胞周期蛋白依赖的蛋白激酶全酶复合物、细胞周期蛋白依赖的蛋白丝氨酸/苏氨酸激酶活性调节等。KEGG分析显示富集的通路主要包括细胞周期、p53信号通路和HIF-1信号通路。
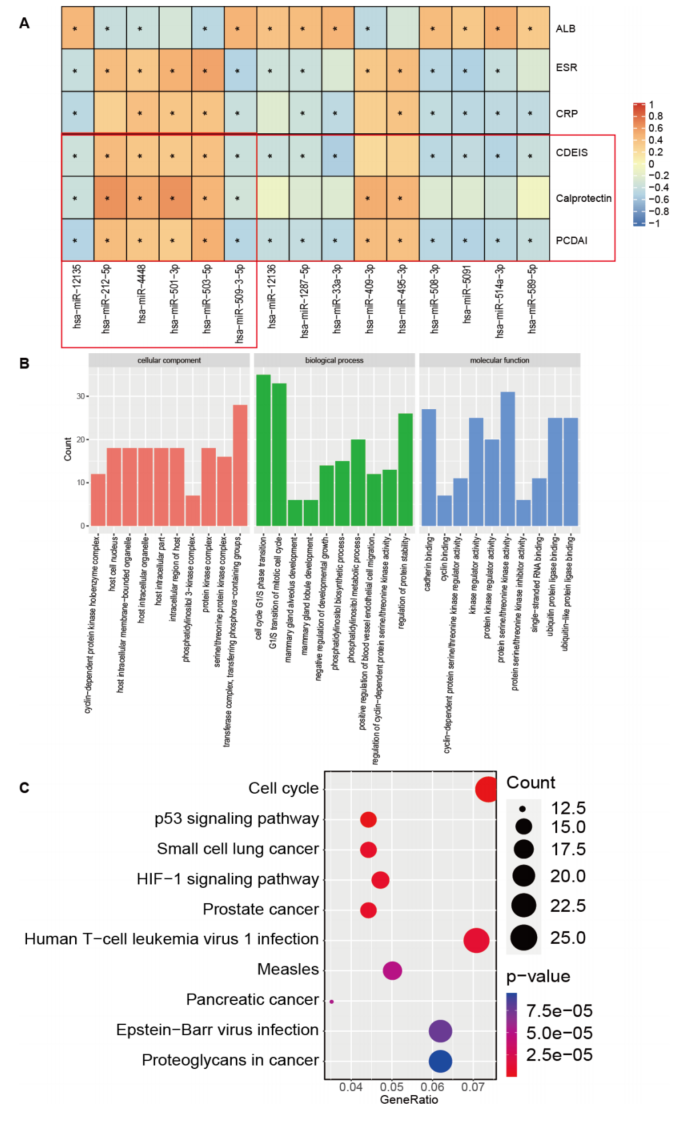
图6 miRNAs与关键临床指标的相关性分析及8种不同miRNAs表达的功能富集分析
6、差异微生物与miRNA之间的相关性
为了研究微生物组和miRNA之间的潜在依赖关系,研究了两个数据集之间的相关性。相关性Sankey图分析直观地显示了七个关键肠道微生物与八个关键miRNAs之间的关联(图7A)。Hsa-miR-509-3-5p、hsa-miR-194-5p、hsa-miR-215-5p和hsa-miR-12135与D. raffinosedens、T. metallivorans、R. intestinalis和Dorea sp. AGR2135呈正相关,而hsa-miR-503-5p、hsa-miR-212-5p、hsa-miR-501-3p和hsa-miR-12135与所有7种关键微生物呈负相关。预测了8个miRNAs的靶基因,图7C是预测的hsa-miR-509-3-5p和hsa-miR-503-5p在D. raffinosedens、T. metallivorans中的结合位点。最终还绘制了7个关键的粪便肠道微生物和8个关键组织miRNAs在儿童CD不同阶段的变化示意图(图8)。

图7 8个关键miRNAs与7个关键肠道微生物表达的相关性分析
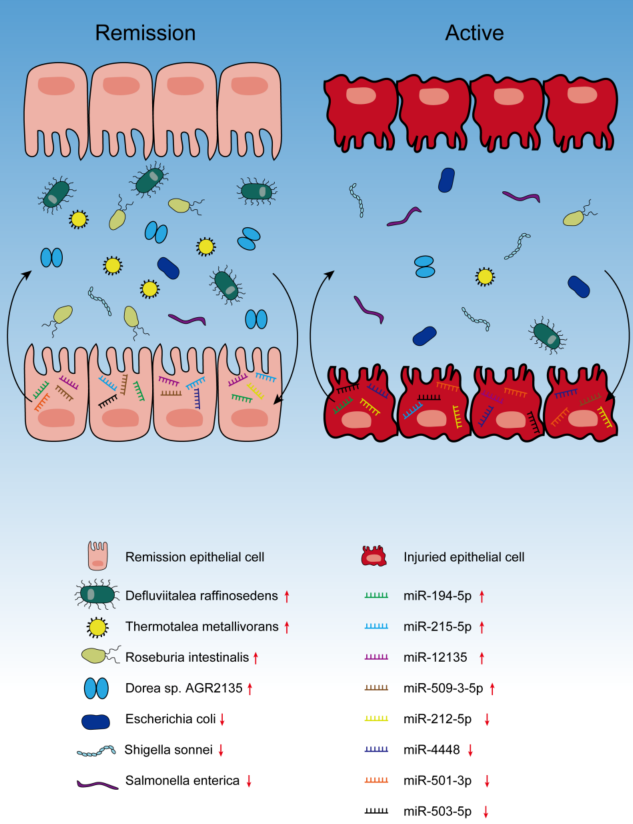
图8 7个关键的粪便肠道微生物和8个关键组织miRNAs在儿童CD不同阶段的变化示意图
三、研究结论
通过宏基因组分析和miRNA测序研究了克罗恩病(CD)不同阶段粪便肠道微生物组(GM)和肠道组织miRNA之间的关系。结果发现CD患者和对照组比较,GM和miRNA谱都发生了显著变化,鉴定出7种关键微生物和8个关键miRNAs之间有密切的相互作用。该研究发现的关键微生物和miRNA可作为潜在分子生物标志物,并有助于探究CD病的分子机制。
参考文献:
Profiles and interactions of gut microbiome and intestinal microRNAs in pediatric Crohn’s disease. [J]mSystems, 2024.