| 时间:2024-08-02 |
2023年发表于《Nature Communications》(IF=14.7)
一、研究背景
非酒精性脂肪性肝病(NAFLD)是最常见的肝脏疾病,自噬是肝脏代谢的重要调节剂,自噬缺陷可能与NAFLD的发病机制有关。Usp39(泛素特异性蛋白酶39)参与了多种疾病的发展,但在肝脏中的生理和病理功能仍不清楚。
二、研究结果
1、在NAFLD和NASH中,肝脏Usp39的表达降低
通过分析GEO数据库中U4/U6.U5 tri-snRNP复合物的16个核心基因的mRNA水平,Usp39和Ddx23均显著下调(图1a, b)。Usp39是NAFLD和NASH小鼠肝脏中与U4/U6.U5 tri-snRNP成分相互作用最强烈的因子之一(图1c)。USP39表达与NAFLD活动评分呈负相关(图1d)。免疫印迹和qPCR检测,发现HFD喂养和MCD喂养的小鼠肝脏中Usp39的表达水平明显低于正常小鼠(图1g, h)。重要的是,与非NASH患者相比,NASH患者肝脏中USP39的表达也有所降低(图1i)。免疫组化染色,发现Usp39主要定位于细胞核,Usp39的蛋白水平显著降低(图1j)。
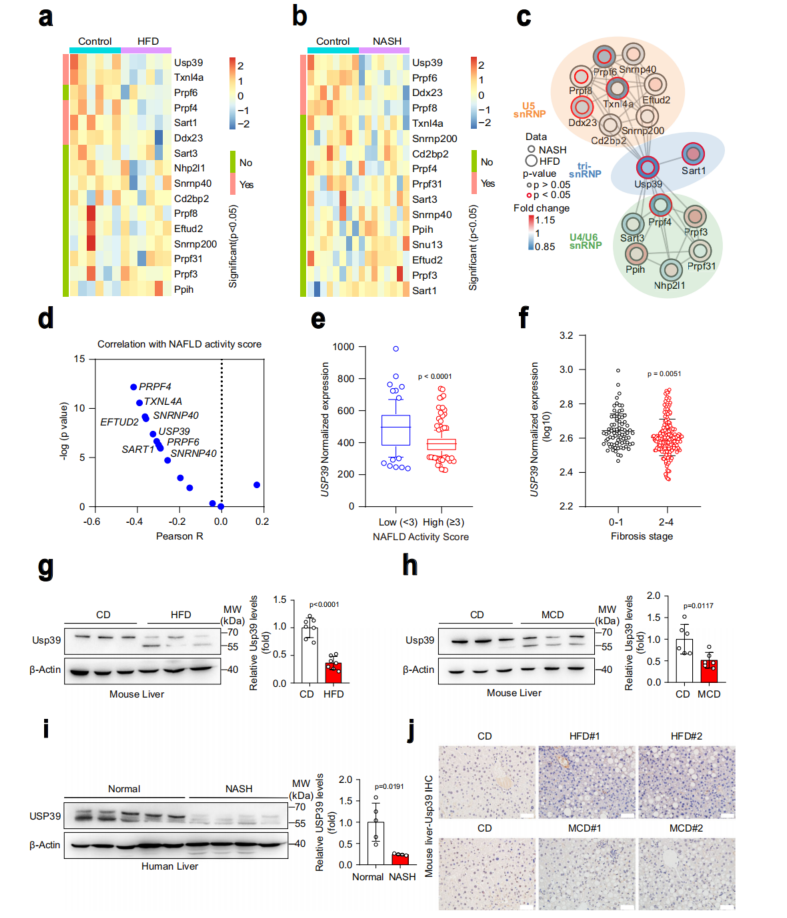
图1 在NAFLD和NASH中,肝脏Usp39的表达降低
2、肝脏Usp39的缺失会损害肝脏的发育和稳态
将Usp39fl/fl小鼠与Alb-Cre小鼠杂交,产生肝脏特异性Usp39敲除小鼠(Usp39-HKO)(图2a, b)。Usp39-HKO小鼠在出生后4至8周的体重显著下降(图2c, d)。在5周龄时,Usp39-HKO小鼠的体重、肝脏重量和肝脏/体重比也有所降低(图2e-g)。与对照组相比,Usp39-HKO肝脏中增殖标志物(Ki67和Pcna)肝细胞增殖的表达增加(图2h-j)。Usp39缺失引起自发性肝损伤,表现为ALT、AST、LDH水平升高,Alb水平降低(图2n)。结果显示,Usp39缺失在5周龄时诱导自发性肝损伤。10周龄Usp39-HKO小鼠的肝损伤明显减轻(图2n-p)。这些数据表明Usp39在小鼠出生后早期肝脏发育中起重要作用。
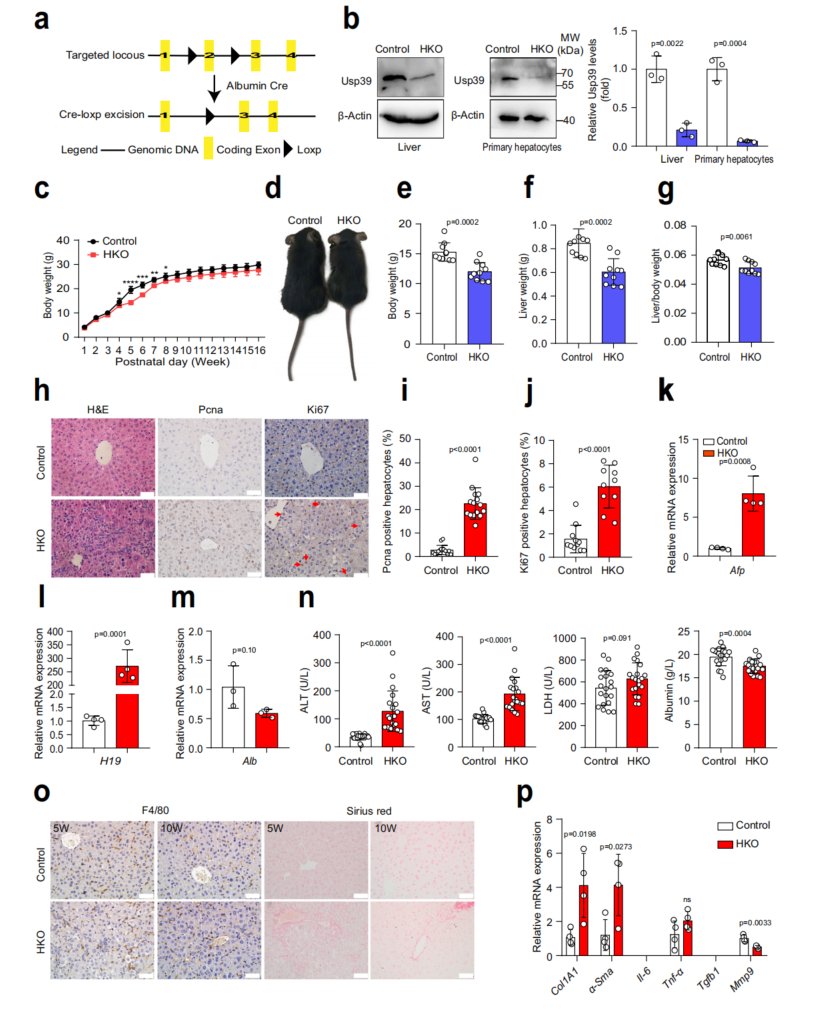
图2 肝脏Usp39敲除会损害肝脏稳态和功能
3、肝细胞特异性Usp39缺失诱导自发性脂肪变性
为了确定肝脏Usp39在肝脏稳态和功能中的具体作用,我们在12月龄时检测了Usp39-HKO和对照小鼠。Usp39-HKO小鼠脾脏肿大,肝脏呈浅色(图3a),H&E和Sirius Red染色显示大脂滴大量积聚,纤维化(图3b)。与此一致,Usp39-HKO小鼠的肝脏TG水平高于对照组(图3c)。此外,炎症和纤维化基因(Col1a1、α-Sma、Tnf-α和Tgfb1)普遍上调(图3d)。10周龄小鼠肝组织切片的油红O染色证实肝细胞特异性Usp39缺失导致肝脏脂质积累。这些发现表明,肝细胞特异性敲除Usp39导致小鼠脂质积累和自发性脂肪变性。
为了进一步阐明Usp39在肝脂肪变性中的作用,对Usp39-HKO小鼠和对照组小鼠进行了为期12周的HFD喂养。HFD喂养的Usp39-HKO小鼠表现出更明显的肝脏脂肪变性和纤维化形成(图3e, f)。肝脏TG水平和炎症和纤维化基因mRNA表达也更为显著地增加(图3g, h)。LC/MS和RNA-seq分析发现与对照小鼠相比,Usp39-HKO小鼠的TG、二甘油酯(DG)、磷脂酰肌醇(PIP2)和鞘碱(So)显著增加(图3i, j)。脂质组和转录组联合分析显示,Usp39-HKO小鼠的肝纤维化和脂肪变性高度富集(图3k-n)。综上所述,这些结果表明Usp39-HKO小鼠更容易患脂肪肝疾病。
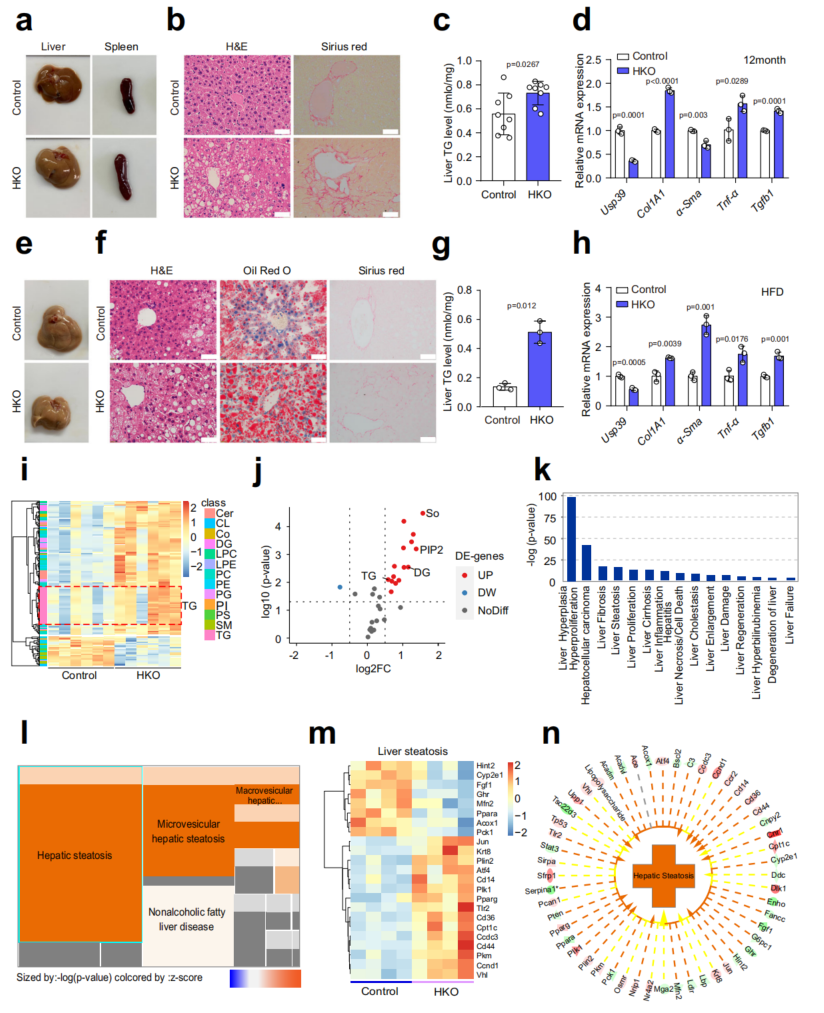
图3 肝细胞特异性Usp39基因敲除小鼠的自发性脂肪变性
4、在肝细胞特异性Usp39缺失的小鼠中,自噬被抑制
为了阐明Usp39缺失导致脂质积累增加的机制,首先测量了与新生脂肪生成相关的基因和脂质脂肪分解。Usp39-HKO肝脏中脂肪生成相关基因显著下调,而脂解相关基因上调(图S5b)。Usp39-HKO肝脏中脂肪积累增加不太可能是由于脂肪分解缺陷、新生脂肪生成、食物摄入量增加或代谢率降低造成的。
功能富集分析显示,与对照组相比,Usp39-HKO肝脏中自噬、TG降解和脂肪酸β-氧化(Fatty Acid β-oxidation,FAO)通路显著减弱,而mTOR信号通路被激活(图4a)。假设Usp39的缺失可能会阻止自噬,从而增加肝内脂滴的积累。通过qPCR评估了自噬相关基因的表达,发现与对照组相比,Usp39-HKO肝脏中的Ulk1、Atg3和Atg7显著下调(图4b)。免疫印迹显示,Usp39敲除,Ulk1、Atg7和LC3 II降低,p62升高(图4d-f)。在电镜下,Usp39-HKO肝脏中自噬小泡的形成明显减少(图4g)。Plin2和Lamp2的共免疫荧光染色显示Plin2的丰度增加,Lamp2的分布减少(图4h)。在Usp39缺失后,原代肝细胞和AML12细胞中的EGFP-LC3点显著减少(图4i)。综上所述,这些结果表明,Usp39-HKO肝脏中的脂质积累可能是由于自噬受损而发生的。
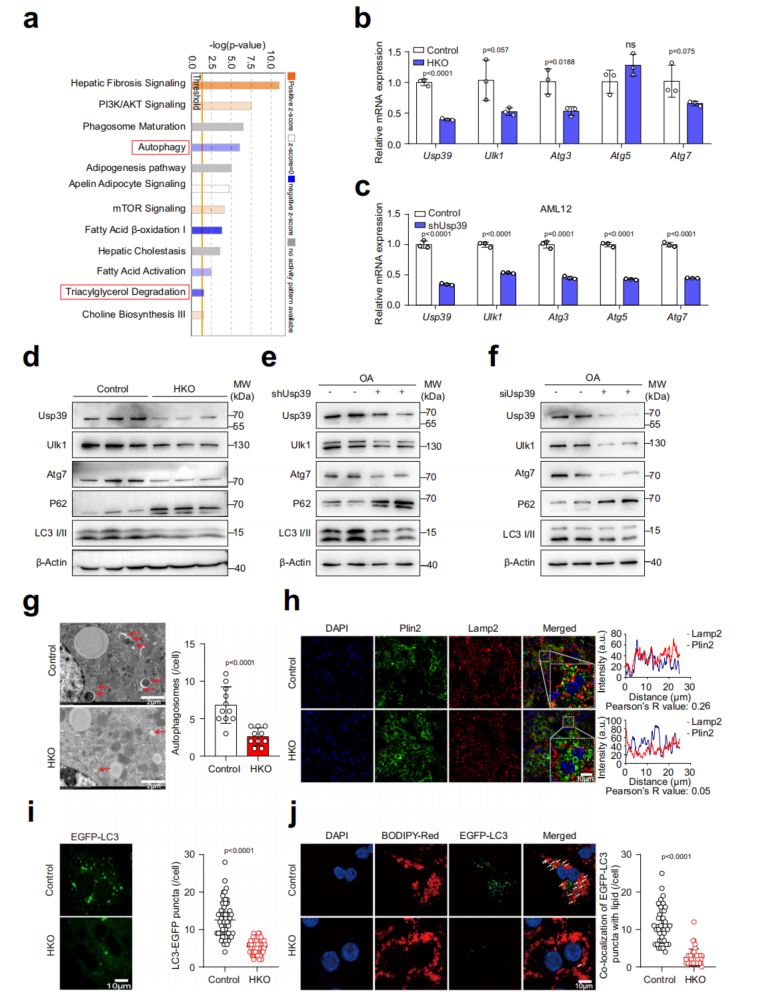
图4 缺乏Usp39的肝细胞的自噬功能受损
5、肝细胞特异性Usp39的缺失导致自噬相关基因的异常剪接
鉴于Usp39是U4/U6.U5 tri-snRNP的一个组成部分,假设Usp39的缺失可能会破坏肝脂质自噬所需基因的RNA剪接。Usp39-HKO和对照小鼠的肝脏组织RNA-seq检测,共检测到1472个基因的1993个剪接事件。热图显示了Usp39-HKO小鼠与对照组相比肝脏组织中自噬相关基因的差异表达(图5b)。
在AML12细胞中进行了RNA免疫沉淀测序(RIP-seq),以确定Usp39的全基因组结合位点和靶点。Motif富集分析,发现GGCCAC和GCCAUA是两个最丰富的元素(图5e)。Usp39结合Motif 1在自噬基因剪接位点附近明显富集(图S7d-f)。为了鉴定Usp39调控的AS候选靶点,利用RIP-seq和RNA-seq数据整合了Usp39结合基因和AS相关基因,鉴定出611个常见基因(图5f)。GO分析发现,与细胞分解代谢过程、剪接体复合体组装、肽酰丝氨酸磷酸化和自噬调控相关的通路显著富集(图5g)。为了确定由Usp39调控的肝脏脂质积累的功能靶点,检测了自噬相关基因Ulk3、Nrbp2、Tcirg1、Trp53inp1和Hsf1的AS模式,这些基因富集于Usp39结合和选择性剪接的转录本中。然后通过AS和结合峰分析(图5h-k)以及RT-PCR(图5l)验证了这些基因的可变剪接。
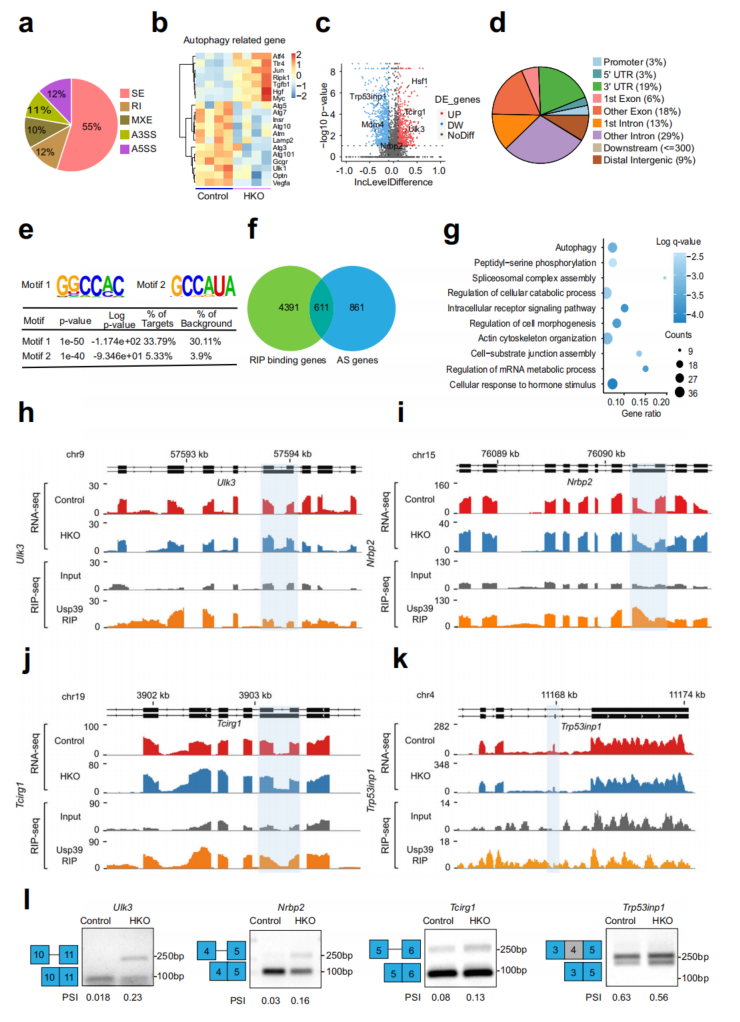
图5 Usp39的缺失导致肝细胞中自噬相关基因的剪接改变
6、Usp39的缺失导致肝细胞中Hsf1的错误剪接和降解
Hsf1是热休克反应的主要转录调节因子,促进细胞保护性自噬。通过分析Hsf1的剪接事件,发现Usp39的缺失导致外显子6的5'剪接位点选择,这引入了一个过早终止密码子(PTC),可能导致无义介导的mRNA降解(NMD)(图6a, b)。半定量RT-PCR进行了验证(图6c)。Hsf1可变剪接随着Usp39添加量的增加而降低,但当Usp39缺失时增加(图6d)。Usp39缺失后,典型异构体显著减少,而NMD异构体显著增加(图6e)。通过RIP证明Usp39与Hsf1的直接结合,RIP-qPCR显示Usp39结合在Hsf1外显子6附近的四个位点(图6g);RNA下拉实验进一步显示生物素标记的Hsf1探针成功下拉了Usp39(图6h)。Usp39耗竭后,Hsf1、Ulk1、Atg7和LC3 II的蛋白水平显著降低,HFD喂养和MCD喂养的小鼠肝脏中Hsf1蛋白水平较低(图61,m)。最后,NASH患者肝脏中Hsf1蛋白表达也较非NASH患者降低(图6n)。综上所述,这些发现表明Usp39的缺失导致Hsf1剪接改变和快速降解。
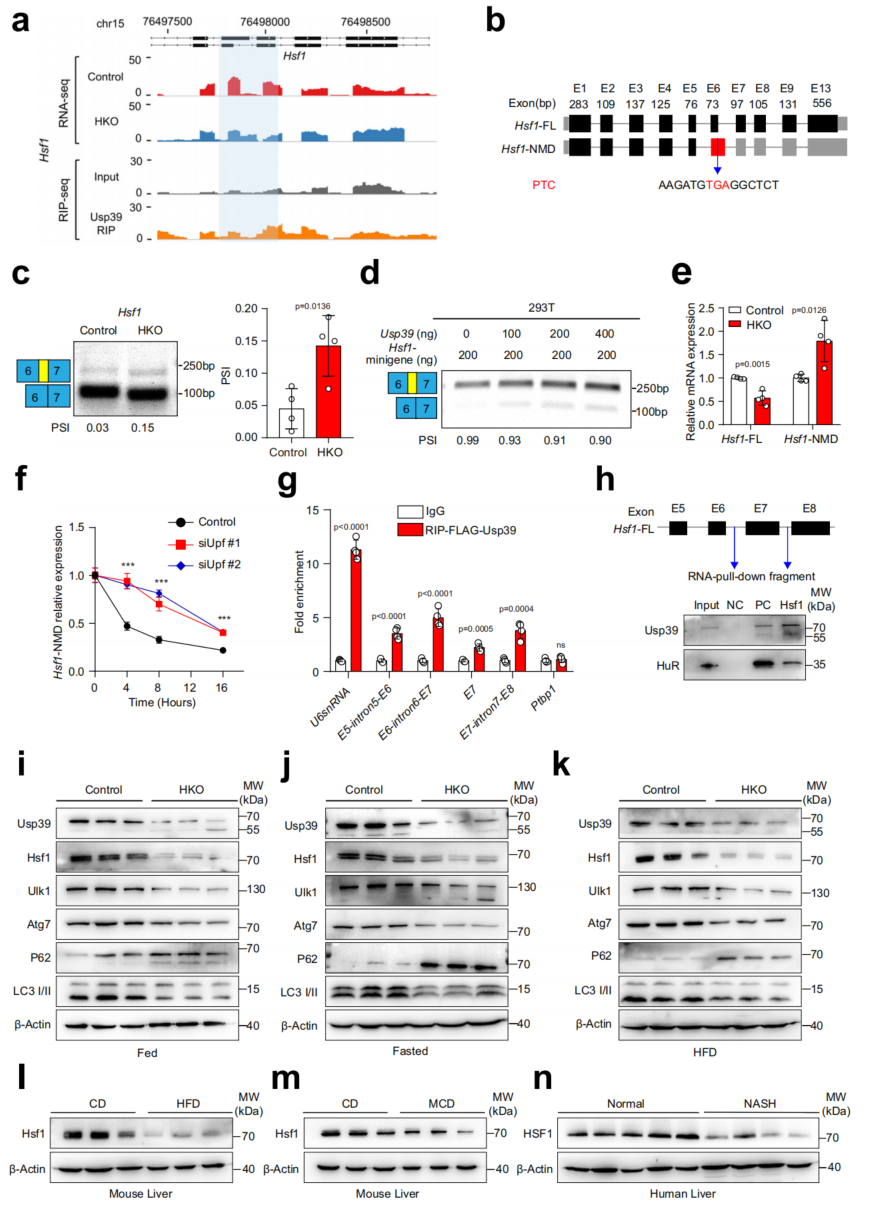
图6 Usp39的缺失导致肝细胞中Hsf1的错误剪接和快速降解
7、Hsf1促进自噬,减轻由Usp39消耗引起的肝脂肪变性
通过rescue实验,以确定Hsf1的下调是否介导了Usp39缺失导致的脂质积累。在AML12细胞中,BODIPY染色显示,过表达Hsf1可以挽救Usp39缺失引起的脂质积累(图7a, b)。相反,通过siRNA敲低Hsf1会破坏Usp39过表达引发的脂质降解。Plin2和Lamp2染色的免疫荧光进一步显示,在AML12细胞中,通过强制逆转Hsf1表达,可以恢复Usp39缺失引起的受损自噬(图7c)。为了加强Hsf1是Usp39的功能靶点,并在肝脏脂质代谢中促进自噬的结论,给Usp39连接小鼠注射AAV8-TBG-Cre或AAV-TBG-Null,以产生肝脏特异性的Usp39-hko小鼠;异位Hsf1表达明显减轻了Usp39缺失引起的肝脂肪变性(图7e)。通过Plin2和Lamp2的免疫染色(图7f)和自噬相关基因的免疫印迹(图7g),可以证明Usp39缺失导致的自噬受损得以恢复。总之,由Usp39缺失引起的肝脂肪变性部分是由Hsf1下调和随后的自噬损伤介导的。
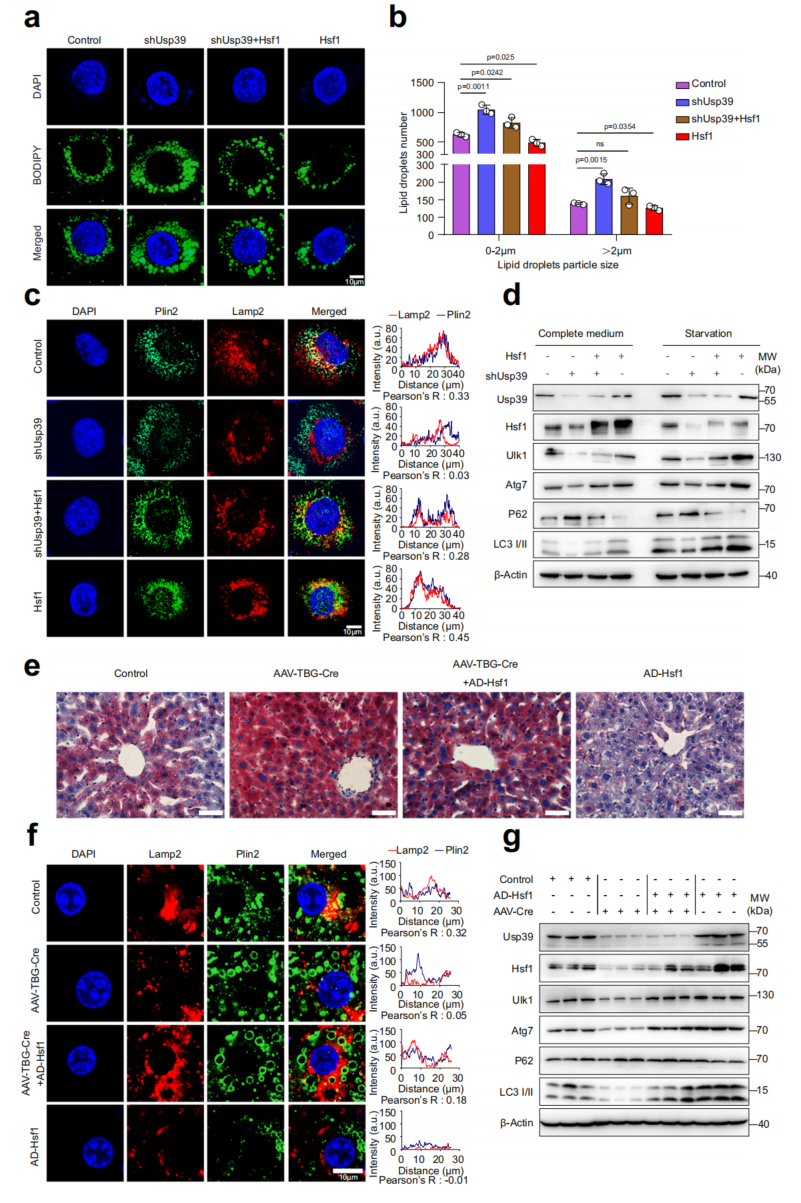
图7 Hsf1促进自噬,减轻由Usp39缺失引起的肝脂肪变性
三、研究结论
Usp39的缺失导致Hsf1剪接位点改变,从而导致其表达减少,从而引起脂质积累。Hsf1过表达可促进自噬,从而缓解Usp39缺失引起的脂质积累。Usp39介导的可变剪接(AS)是维持肝脏自噬和脂质稳态所必需的。
参考文献:
Spliceosome component Usp39 contributes to hepatic lipid homeostasis through the regulation of autophagy.[J]Nature Communications, 2023.