| 时间:2024-06-21 |
2024年发表于《Advanced Science》(IF =15.1)
一、研究背景
在脊椎动物中,大脑中的下丘脑在控制能量平衡方面起着重要作用。已有研究表明,下丘脑信号失调导致了膳食性肥胖的发生。肥胖人群的增加是遗传因素和环境因素共同驱动,大量RNA-seq数据表明,高热量膳食能够显著影响下丘脑基因表达。
表观遗传学是将环境因素与基因表达联系起来的机制之一,饮食的改变与肥胖表型之间存在明显的联系,组蛋白修饰和DNA甲基化等表观遗传事件在转录调控中起着至关重要的作用。组蛋白修饰,如H3K4me3、H3K27ac、H3K9me3、H3K27me3和H3K36me3,富集于基因组的特定区域,与基因活性呈正相关或负相关。相比之下,启动子区域的5-甲基胞嘧啶主要与基因表达的抑制相关。以往的研究表明,下丘脑表观遗传特征在动物发育过程中及其他生理过程中会发生变化。然而,目前还缺乏全面的研究,尤其是在高脂肪饮食(HFD)导致肥胖的情况下。本研究利用ChIP-seq、MeDIP-seq、snATAC-seq和RNA-seq方法,分析了高脂饮食对下丘脑表观特征的影响。
二、研究结果
1、小鼠下丘脑中的染色质状态研究
为了研究表观遗传变化,分别采集了喂食HFD 1、3、6个月,喂食鼠粮3、6个月的小鼠下丘脑作为实验对照(图1a);然后对下丘脑组织进行ChIP-seq,以定位组蛋白的DNA结合位点;通过MeDIP-seq进行DNA甲基化研究(图1a)。在5个组蛋白修饰标记中,H3K4me3多与转录活性基因相关,H3K27ac与启动子和增强子区域的活性增加有关,H3K9me3对应于被抑制或沉默的位点(如异染色质区域),H3K27me3与多聚酶抑制有关,H3K36me3与转录区有关。用Circos图来展示表观遗传标记的染色体分布(图1a),H3K27ac较少定位于X或Y染色体,而其他标记则均匀分布在染色体上(图1a)。除H3K27ac外,超过一半的组蛋白修饰标记峰位于基因间区域(图1b),表明远端区域在基因表达调控中起作用。此外,除H3K36me3外的所有组蛋白标记,启动子区域的峰数均大于位于外显子或内含子区域(图1b)。
接下来,使用ChromHMM整合五个ChIP-seq数据集来区分染色质状态,利用3月龄喂小鼠的数据集对ChromHMM的参数进行优化,确定6种染色质状态(图1c)。其中状态1-3(S1-S3)分别定义了活性转录起始位点(active transcription start site, TSS)、侧翼转录起始位点(flanking TSS)和双价转录起始位点(bivalent/poised TSS)。S1高度富集H3K4me3和H3K27ac,S2高度富集H3K27ac,S3高度富集H3K4me3和无活性标记H3K9me3和H3K27me3(图1c)。S5和S6具有较少的组蛋白修饰标记,因此认为它们是静止状态(图1c)。在HFD-1M、HFD-3M、Chow-6M和HFD-6M数据集中,静止状态(S5-S6)分别覆盖了97.51%、97.17%、89.37%和95.35%的基因组。这些数据表明,在不同的处理组中,染色质状态的覆盖率略有不同,并且小鼠下丘脑的大多数基因组区域(大于80%)处于较低的活跃状态。
通过染色质状态可以表明基因的转录情况。Marcks位点是一个先前发现的下丘脑富集基因,参与蛋白激酶c依赖性钙调素信号的调节。Marcks基因座富含S1和S2的开放染色质标记(图1d)。同时,S3定义了一种具有活性和非活性组蛋白标记的二价状态。Insm2基因是蜗牛转录抑制因子超家族的成员,对胰岛中葡萄糖刺激的胰岛素分泌很重要。数据表明,Insm2基因呈现二价状态(S3),在Chow-3M和HFD-3M小鼠下丘脑的位点上有H3K4me3、H3K9me3、H3K27me3和H3K36me3标记(图1e)。相比之下,HFD-1M中的Insm2位点处于活跃的染色质状态(S1)。在Chow-6M和HFD-6M小鼠中,Insm2基因位点处于活跃状态,但也有H3K27me3富集现象。
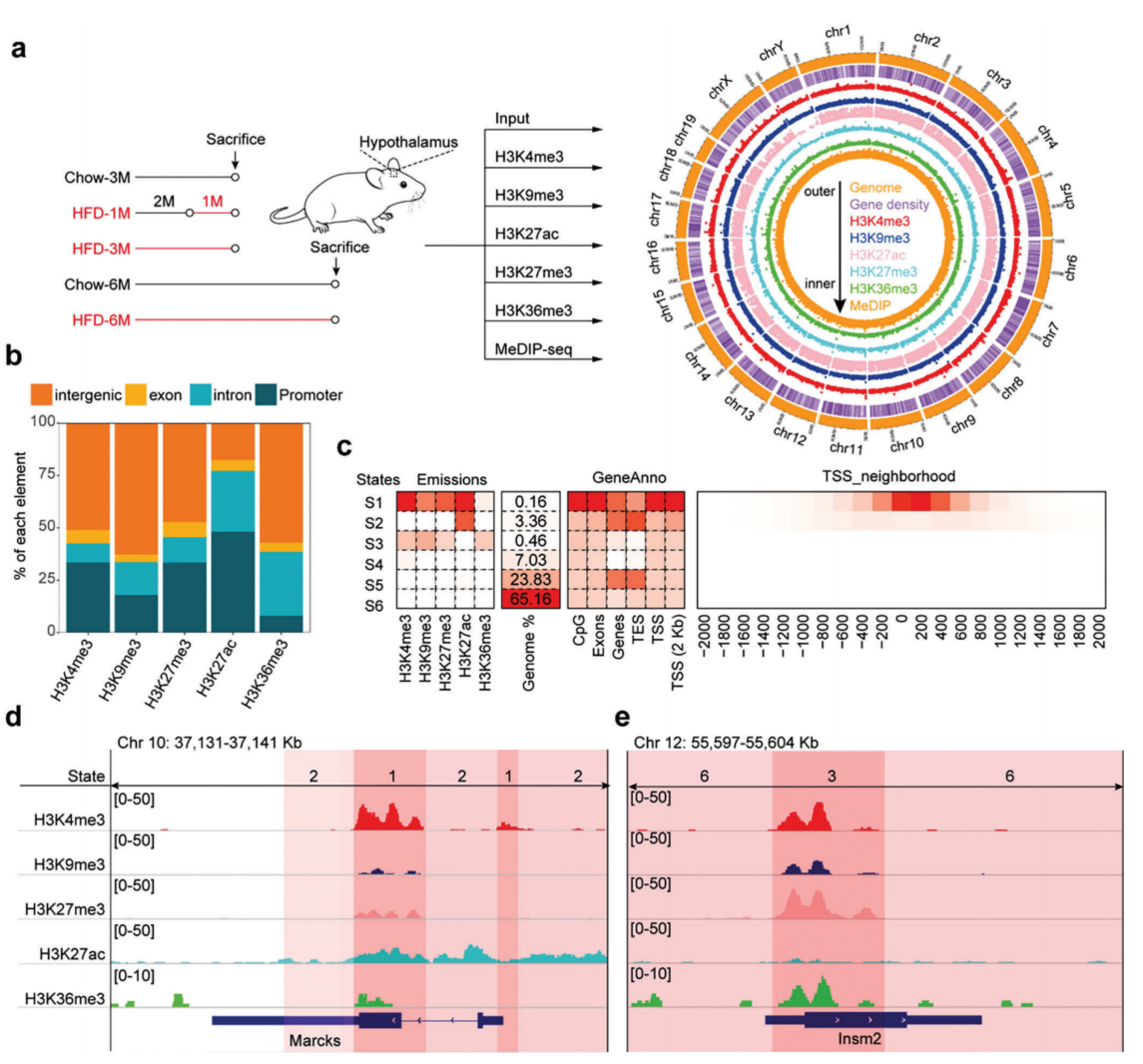
图1 表观遗传修饰塑造了小鼠下丘脑的染色质状态
2、HFD喂养导致下丘脑组蛋白修饰失调
使用MEDIPS工具分析ChIP-seq数据集,以确定HFD喂养是否影响组蛋白修饰。H3K36me3富集于转录区,其他组蛋白修饰主要富集在启动子和增强子区域,因此选择注释为启动子的区域进行进一步分析。在分析H3K36me3 ChIP-seq数据时,也包括了基因体区域。使用火山图来显示启动子区域富集H3K4me3、H3K9me3、H3K27me3、H3K27ac或H3K36me3的基因(图2a)。与3个月或6个月的治疗相比,1个月的HFD治疗显著影响组蛋白修饰(图2a,b)。这些数据表明,1-6个月的HFD喂养可以解除组蛋白修饰,但推断下丘脑整体基因表达的变化在长时间的HFD喂养后趋于减弱(图2b),这意味着长时间(6个月)的HFD处理可能引发组蛋白修饰的适应,例如Nrxn1。Nrxn1是Neurexin家族基因之一,是神经回路的中枢调节因子;与喂食3个月的鼠粮相比,喂食HFD 1个月或3个月的小鼠下丘脑Nrxn1的表观遗传修饰发生了显著变化,而6个月没有显著变化。
组蛋白修饰与基因转录密切相关,ChIP-seq和转录组数据进行综合分析(图2c,d)。1个月的HFD喂养比其他两种饮食方案更显著地上调了基因,而其抑制基因表达的效果则不那么明显(图2c,d)。为了研究相关途径,进行了GO分析。这些基因在DNA结合和染色质组织等生物过程中高度富集(图2e)。此外,还检测到参与神经元和前脑发育的基因富集(图2e),这表明HFD治疗可能影响下丘脑神经元的发育。
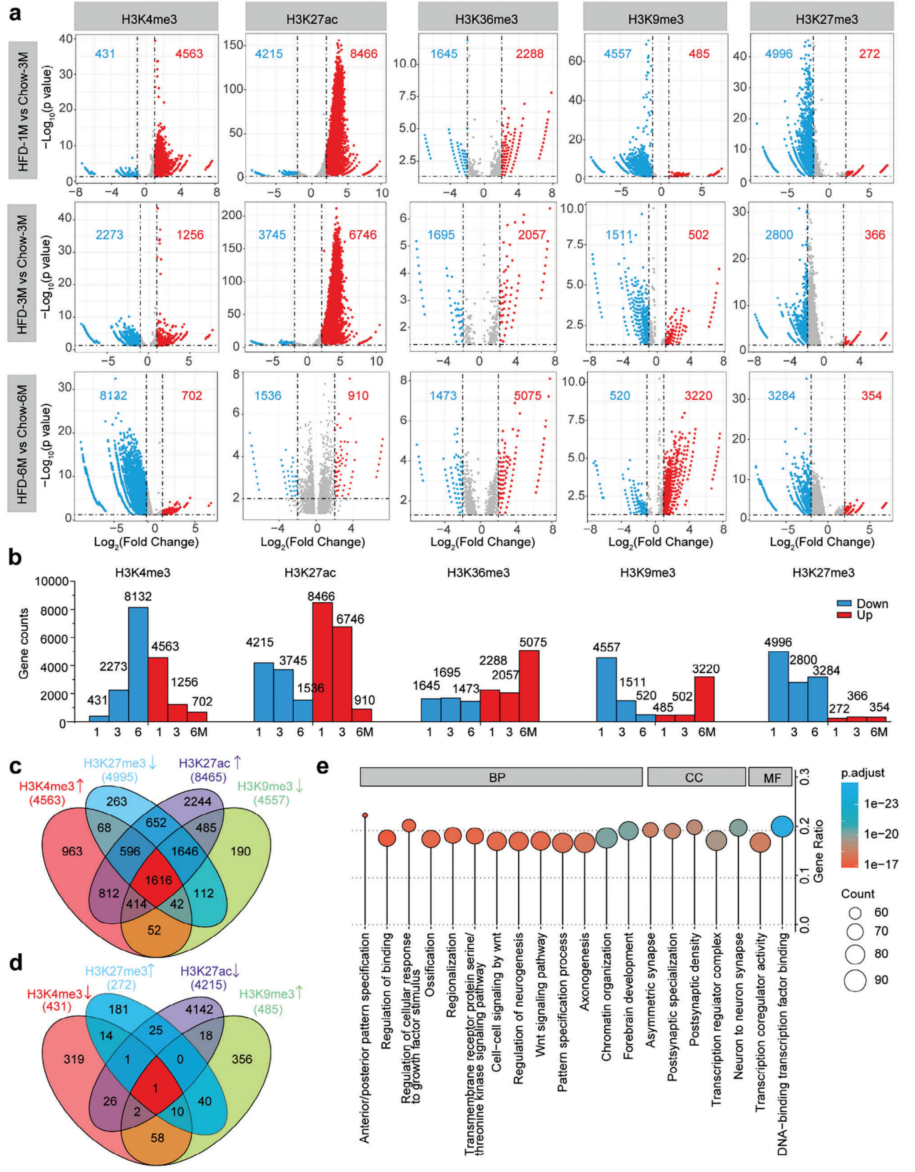
图2 联合ChIP-seq分析揭示了HFD喂养后组蛋白修饰变化
3、组蛋白修饰的趋势分析
接下来分析了HFD喂食后组蛋白修饰变化的趋势。析表明,这些变化可以聚类为9个pro-files(图3a)。随后,整合了活性组蛋白修饰标记(H3K4me3和H3K27ac)以及抑制性组蛋白修饰标记(H3K9me3和H3K27me3),揭示了常见的受影响的、翻译后修饰的组蛋白相关基因(图3b,d)。每个谱中活性标记或非活性标记之间的重叠基因不太明显(图3c,e)。值得注意的是,鉴定出的基因中有一部分似乎与神经元生长有关,如Kif13b、Gabra2、Sorcs2、Sptbn1、和Nacc1,还有一些与棕色脂肪组织的分化有关,如Ncoa1和Prdm16(图3c,e)。
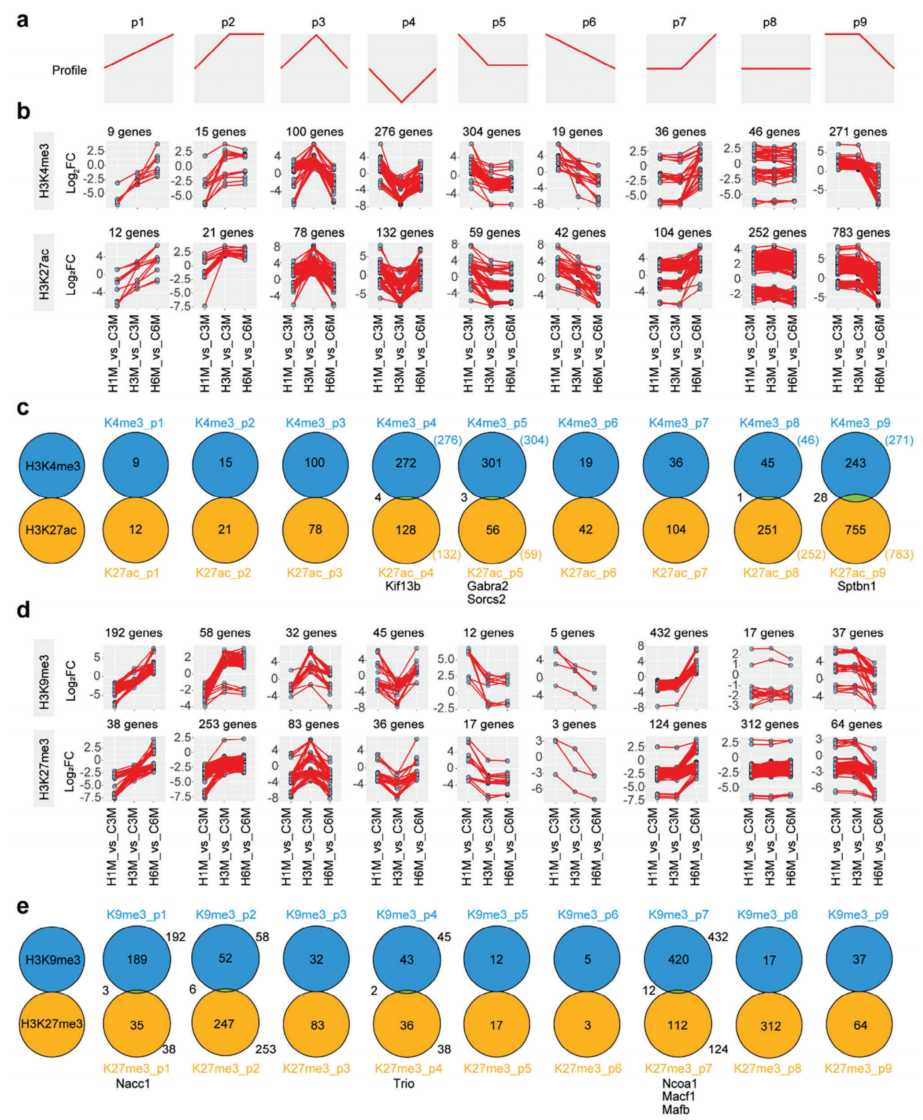
图3 HFD处理后组蛋白修饰的趋势分析
4、HFD喂养改变了下丘脑的DNA甲基化
为了评估HFD治疗对下丘脑DNA甲基化的影响,进行了MeDIP-seq,并评估了在上述分析中建立的每种染色质状态的DNA甲基化水平(图1c)。每种染色质状态的甲基化水平是根据MeDIP-seq峰相对于每种染色质状态所占据的基因组区域的比例来计算的(图4a)。数据显示,状态S1-S4有更多的甲基化DNA片段,除了在Chow-3M数据集中的状态S2和S4,这两个状态都有较少的H3K9me3和H3K27me3富集(图1c,4a)。此外,状态S5和S6表现出低水平的DNA甲基化(图4a)。
MeDIP-seq峰主要富集于基因间区和内含子区。相比之下,启动子和外显子区域的DNA甲基化水平相当低(图4b)。然后,分析了鼠粮喂养和HFD喂养小鼠之间甲基化区域的差异。与ChIP-seq数据一致,与3个月或6个月相比,1个月的HFD喂养导致DNA甲基化区域受影响的基因更多(图4c-h),这意味着长期HFD喂食也会导致小鼠下丘脑DNA甲基化的适应。使用维恩图来说明具有差异甲基化区域的重叠基因(图4i)。还分析了ChIP-seq和MeDIP-seq数据,以确定饮食肥胖的常见影响基因(图4j)。然后对这些基因进行GO分析,结果表明,这些基因富集于DNA结合转录激活子活性、突触膜和神经元分化调控等生物过程(图4k)。
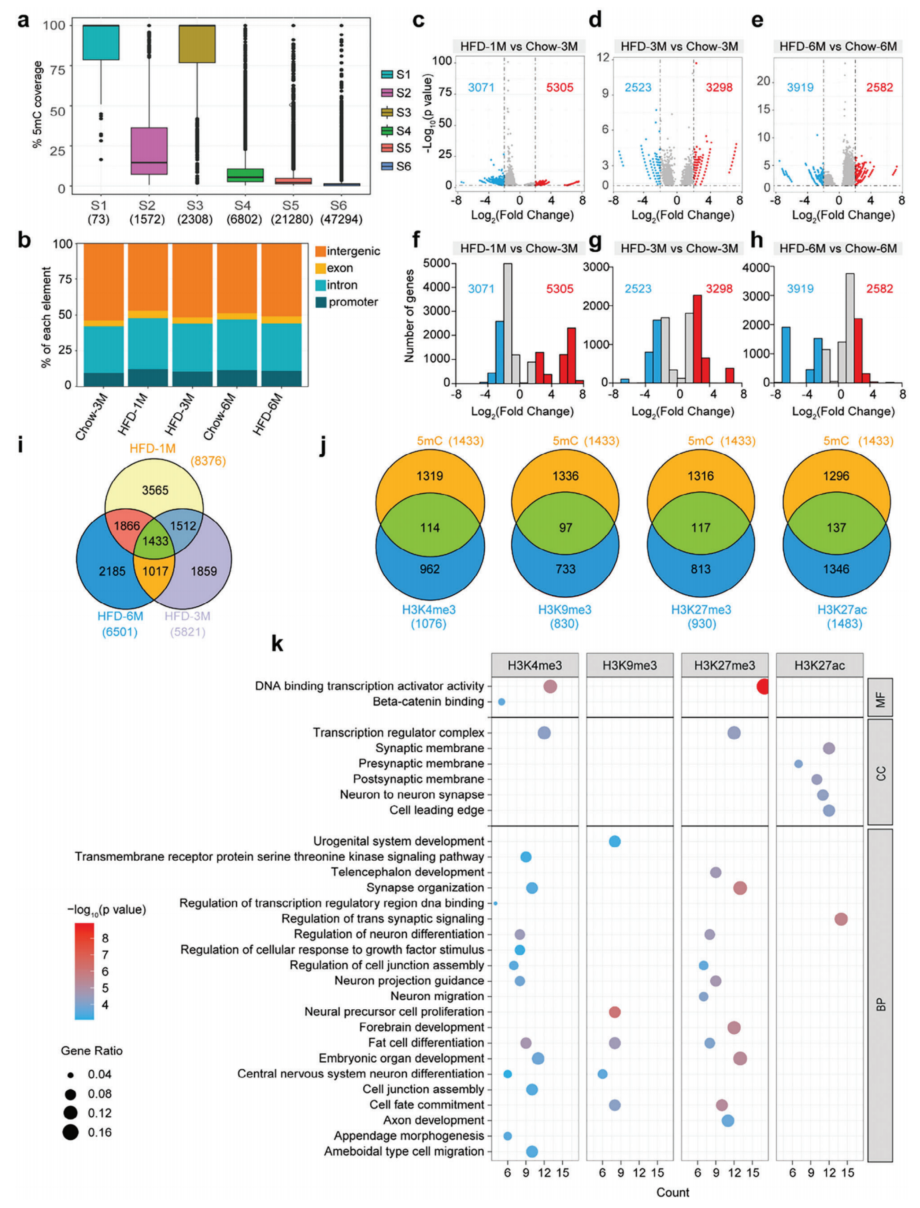
图4 HFD喂养影响下丘脑DNA甲基化
5、HFD喂养差异影响下丘脑细胞染色质可及性
下丘脑主要由神经元细胞、胶质细胞和内皮细胞组成。snATAC-seq是一种成熟的检测单个细胞中开放染色质的方法,并且snATAC-seq峰值的强度与活性组蛋白标记具有良好的相关性,但与H3K27me3(一种抑制性组蛋白标记)相关性不强。接下来,使用10x Genomics Chromium平台对喂食鼠粮或HFD(1个月)的小鼠下丘脑组织进行了snATAC-seq分析(图5a)。总共获得了16883个snATAC-seq数据集。分别为Chow-3M和HFD-1M数据集生成了统一流形近似和投影(UMAP)图,然后将这两个实验组的UMAP图聚合在一起(图5b)。使用snATAC-seq数据集,能够识别下丘脑的所有主要细胞类型,如兴奋性神经元、抑制性神经元、星形胶质细胞、小胶质细胞、少突胶质细胞、少突胶质细胞前体细胞(OPC)和内皮细胞(图5b),基于由染色质可及性推断的细胞类型特异性标记基因活性(图5c)。
由snATAC-seq数据可知,成年小鼠下丘脑由5.9%的兴奋性神经元、51%的抑制性神经元、12.5%的星形胶质细胞、4.4%的小胶质细胞、22.2%的少突胶质细胞、3.6%的OPCs和少量内皮细胞组成。饲喂HFD后,下丘脑中抑动性神经元、OPCs和内皮细胞等各种细胞类型的百分比保持不变,而兴奋性神经元和少突胶质细胞的百分比分别增加了67.8%和20.7%,星形胶质细胞的百分比减少了57.6%。随后,比较了两种饮食方案中每种细胞类型中染色质可及性所归因的基因活性。该分析表明,1个月的HFD喂养使除内皮细胞外的所有细胞类型的基因活性失调,抑制性神经元、少突胶质细胞和兴奋性神经元是受影响最大的三种细胞类型(图5d,e)。内皮细胞缺乏变化可能是由于检测的细胞数量较少。此外,饮食性肥胖小鼠中相当一部分基因的活性升高(图5d,e),这与使用ChIP-seq数据集计算的基因活性模式一致(图2a,b)。比较了两种细胞类型之间或三种最显著受影响的细胞类型之间的受影响基因列表。下丘脑细胞似乎受到了不同程度的影响(图5f),可能是由于它们在控制能量平衡和其他生理过程中的独特功能。对基因集进行GO分析(图5g),兴奋性神经元中的差异基因主要富集为囊泡相关的生物过程,抑制性神经元富集为电压门控阳离子通道活性,星形胶质细胞富集为动力蛋白相关的生物过程,小胶质细胞富集为钾离子通道活性,少突胶质细胞富集为突触膜等(图5g)。
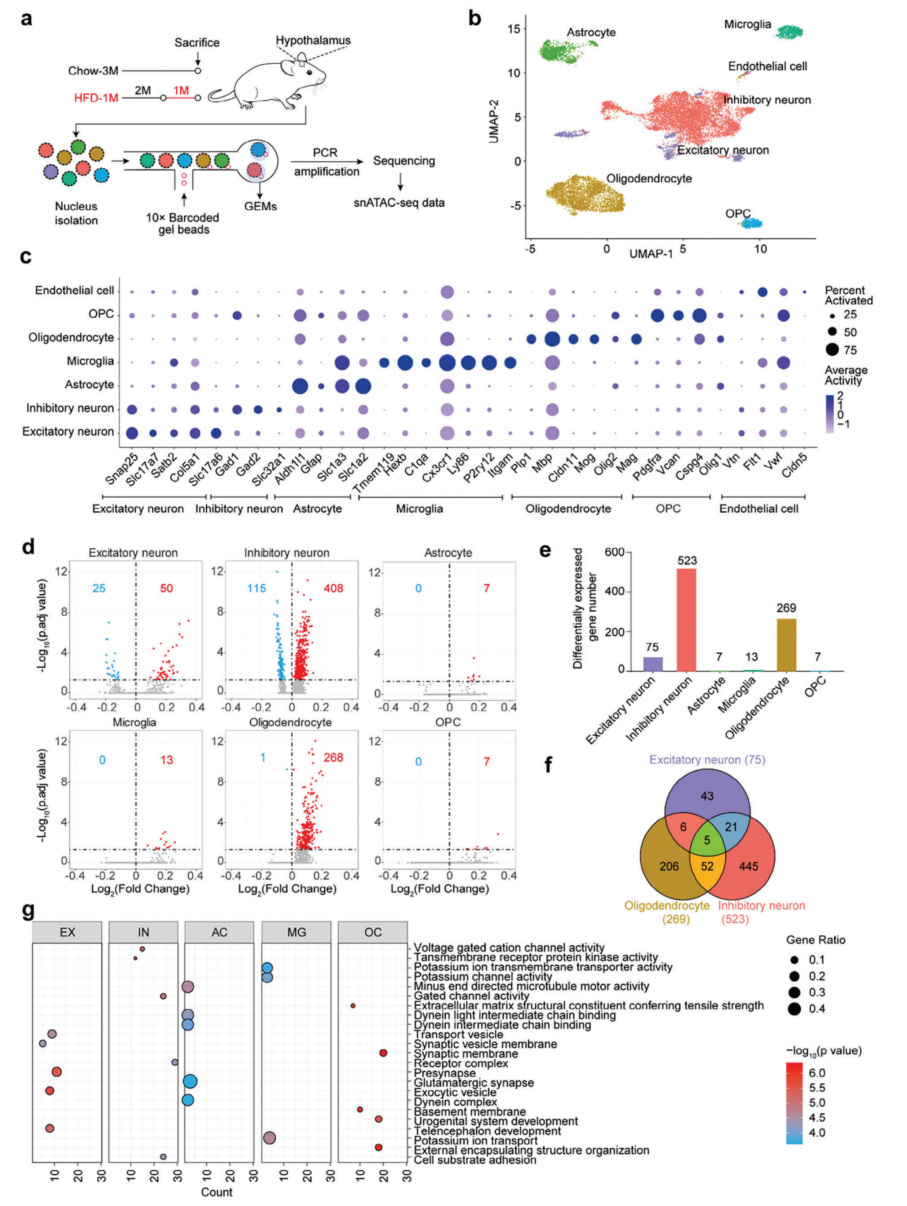
图5 HFD喂养1个月后下丘脑的单核染色质可及性分析
6、HFD喂养后的转录组变化
接下来,对喂食了3个月的鼠的下丘脑进行了转录组学分析。获得120个上调基因和141个下调基因(图6a)。GO分析显示这些基因富集于激素活性和DNA结合转录激活子活性。随后,整合了RNA-seq和ChIP-seq数据,将120个上调基因与H3K4me3、H3K27ac和H3K36me3显著相关的基因相交,但与启动子中的H3K9me3或H3K27me3不相关。总体结果如Sankey图显示(图6b)。对常见受影响的基因进行GO分析,并绘制了互作网络图(图6c,d)。在Chow-3M和HFD-3M小鼠中,Inhbb启动子被归类为S1状态(图6e),这被定义为一种活性状态。Chow-3M中高度富集的活性标记H3K4me3与无活性的表观遗传标记H3K9me3和H3K27me3,以及HFD-3M中高度富集的活性标记H3K27ac和非活性标记H3K9me3(图6e)。hhbb启动子区域H3K27ac的增加和H3K27me3的减少,表明3个月HFD喂养小鼠中Inhbb的上调(图6e)。促肾上腺皮质激素释放激素(CRH)在下丘脑室旁核中表达。[53]其在饮食性肥胖小鼠中的表达受到抑制,这与Crh位点从Chow-3M小鼠的染色质状态S1向HFD-3M小鼠的染色质状态S6的转变一致(图6f)。后者被定义为静止状态。
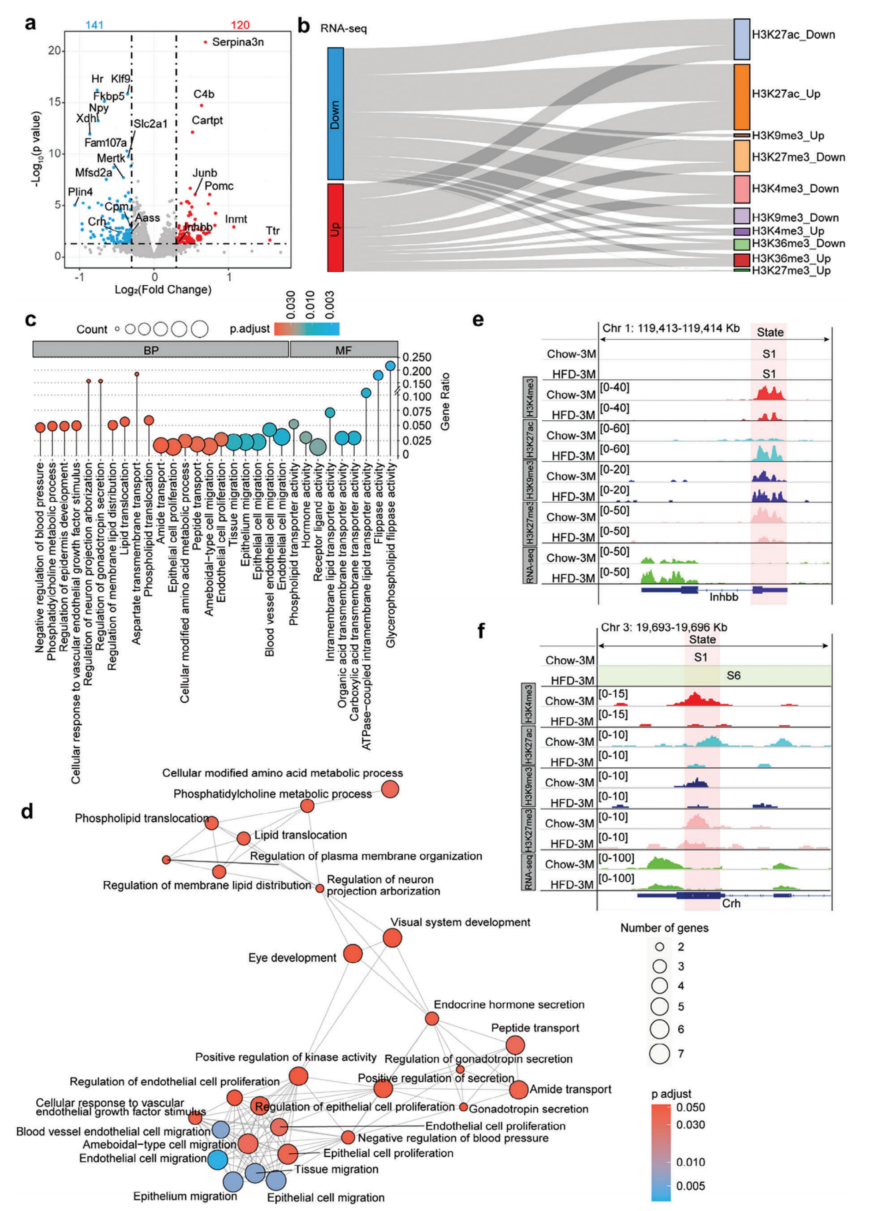
图6 转录组分析
三、研究结论
通过对鼠粮、HFD喂养不同时间的C57 BL/6小鼠下丘脑组织进行ChIP-seq、MeDIP-seq、snATAC-seq、RNA-seq分析,表明1个月的HFD喂养比3个月或6个月更明显的组蛋白修饰和DNA甲基化失调。此外,HFD喂养对下丘脑细胞染色质可及性的影响也存在差异。
参考文献:
The Hypothalamic Epigenetic Landscape in Dietary Obesity.[J]Advanced Science, 2024.