| 时间:2024-06-07 |
2023年发表于《Cell Reports》(IF =8.8)
一、研究背景
RNA在转录后会进行各种修饰,其中N6甲基腺苷(m6A)修饰在哺乳动物mRNA中普遍存在。甲基化RNA免疫沉淀测序(MeRIP-seq)能够检测整个转录组中全面的m6A修饰位点。已有研究表明m6A公认的功能是调节mRNA稳定性,参与pre-mRNA加工和翻译,影响多种生理机制,包括细胞增殖、免疫稳态、干细胞分化、有丝分裂和性别决定。此外,异常的m6A修饰还参与包括癌症在内的多种疾病的发生和进展。
m6A修饰的水平由几种“writer”甲基转移酶和“eraser”去甲基化酶质动态调节,并通过“reader”结合蛋白发挥其作用。典型的writer复合体包含类甲基转移酶3(METTL3)和METTL14,其中METTL3是关键的RNA甲基转移酶。METTL14介导的靶标识别的机制及其生物学作用仍然很大程度上未知。一项泛癌分析在METTL14的高度保守的氨基酸残基R298处发现了一个突变热点。METTL14 R298P突变主要在子宫内膜癌患者中发现,而R298C和R298H突变在多种实体瘤中观察到(图1A),这表明R298在METTL14的功能中发挥着关键作用。之前的一项研究报告称,METTL14 R298P突变体的过度表达不会引起子宫内膜癌细胞中的基序改变。因此,METTL14 R298P突变被认为是功能失调的突变。
在本研究中,通过在HEC108子宫内膜癌细胞中插入杂合或纯合R298P突变来研究METTL14 R298P突变是否仅仅是功能丧失突变。这种干预并不影响细胞中METTL14或METTL3的表达。结果发现,虽然含有突变型METTL14 (R298P)的writer复合物降低了甲基化活性,但其在异常基序上修饰了m6A,这在含有纯合R298P突变的细胞中很明显。异常修饰改变了周围典型基序的甲基化效率,改变了某些mRNA的稳定性,进而影响了细胞增殖率。
二、研究结果
1、杂合子和纯合子METTL14 R298P突变对癌细胞增殖产生相反的影响
为了研究癌症相关的METTL14 R298P突变如何影响m6A甲基化模式及其生物学影响,首先使用CRISPR-Cas9建立了携带METTL14 R298P突变的子宫内膜癌细胞系(HEC108),并获得了多个携带METTL14 R298P突变的克隆。杂合条件(METTL14+/Mu)或纯合条件(METTL14Mu/Mu)中的METTL14 R298P突变以及插入以增加同源重组的沉默突变(SM)(图1B和1C)。观察到METTL14 R298P突变不影响METTL14或METTL3的蛋白表达(图1D)。此外,根据公共数据库表明HEC108细胞中的METTL14拷贝数为2,我们观察到我们建立的METTL14突变的HEC108细胞系也含有两个METTL14基因拷贝(图1E和1F)。
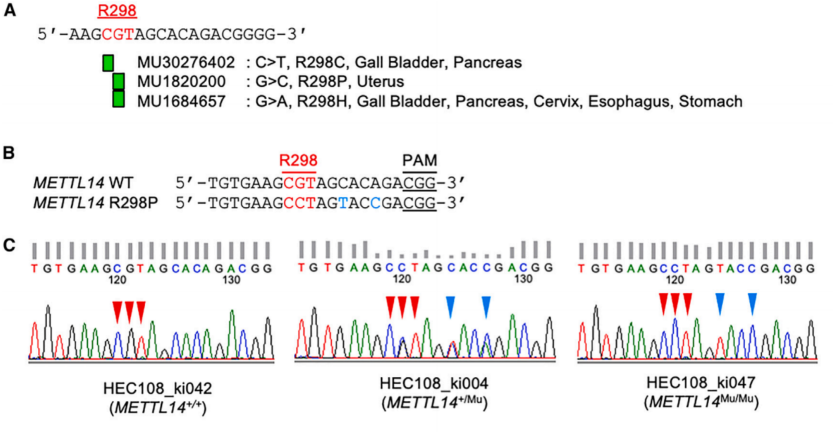
图1 通过基因组编辑建立携带METTL14 R298P突变的子宫内膜癌细胞系
接下里评估了METTL14 R298P突变如何影响体外和体内细胞增殖。与野生型(METTL14+/+)细胞相比,携带METTL14+/Mu突变的HEC108细胞在体外表现出增强的细胞增殖率(图2A)。相反,METTL14Mu/Mu突变显着降低了细胞增殖率。在仅含有SM的METTL14转基因的HEC108细胞中表达METTL14蛋白来检查SM的效果。分析表明,SM不影响蛋白质表达或细胞活力,细胞增殖率的差异是由杂合和纯合R298P突变引起的,与SM不相关。为了在体内评估这种差异,将HEC108细胞皮下注射到裸鼠体内建立异种移植小鼠模型。观察到METTL14+/Mu细胞形成的肿瘤明显比METTL14+/+细胞大,而携带METTL14Mu/Mu突变的细胞形成的肿瘤明显更小(图2B)。此外,当腹腔注射到小鼠体内时,METTL14+/Mu细胞明显形成更多的腹膜肿瘤,METTL14Mu/Mu细胞形成的肿瘤明显较少(图2C)。
通过ICGC分析了RNA-seq结果,没有观察到METTL14基因的拷贝数改变。相比之下,在大多数情况下,METTL14 R298P和R298H突变的等位基因频率均低于50%,这意味着该突变在大多数癌症样本中是杂合的(图2D)。综上结果表明,在癌症样本中METTL14 R298P杂合突变可促进致瘤性,纯合突变对癌症进展发挥抑制作用。
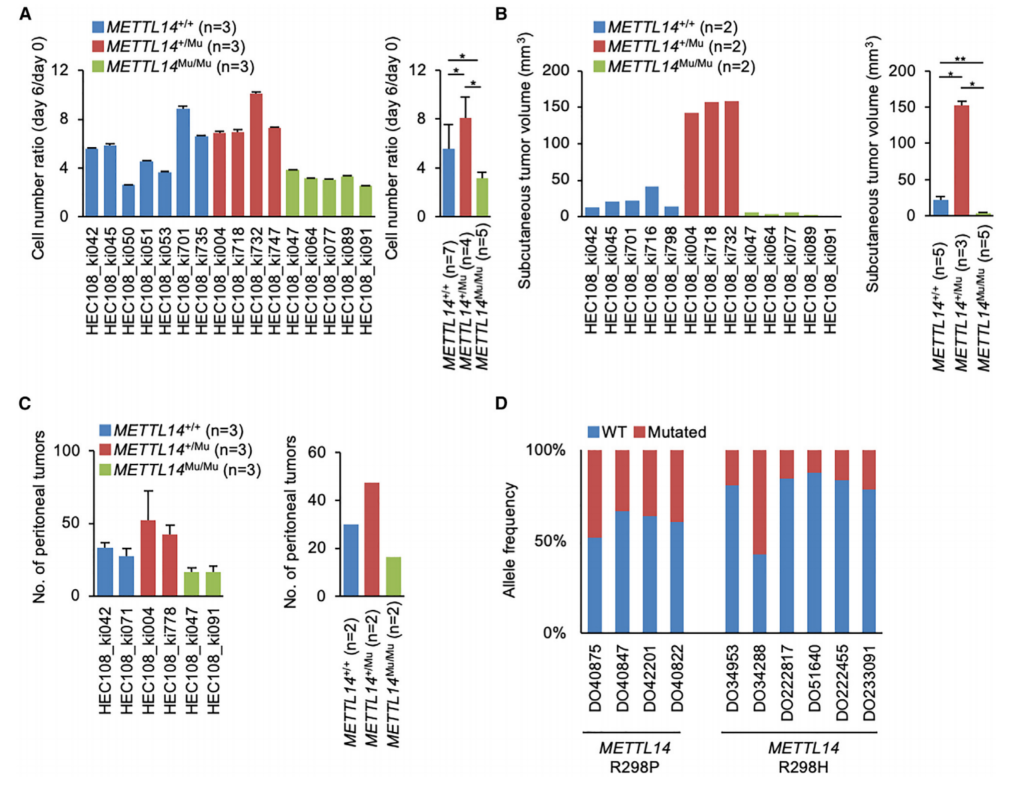
图2 杂合子和纯合子的METTL14 R298P突变对癌细胞增殖的相反影响
2、METTL14 R298P突变减少m6A修饰
为了阐明METTL14+/Mu和METTL14Mu/Mu突变对癌细胞增殖产生相反影响的分子机制,本研究比较了每种基因型中m6A修饰水平。质谱分析表明,METTL14+/Mu细胞中m6A修饰水平显着降低,并且METTL14Mu/Mu细胞中水平进一步降低(图3)。进一步证实SM不影响m6A修饰。这些结果表明METTL14 R298P突变降低m6A修饰的总水平与突变蛋白剂量相关;然而,酶活性或靶标识别的简单丧失不太可能是METTL14+/Mu和METTL14Mu/Mu细胞之间细胞增殖率差异的唯一原因。
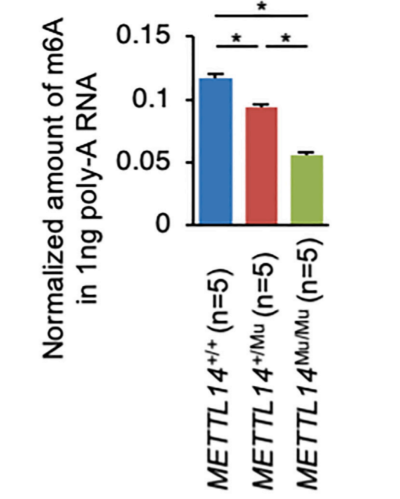
图3 METTL14 R298P突变减少了子宫内膜癌细胞系中m6A的修饰
3、突变体METTL14 (R298P)识别m6A修饰的异常基序
鉴于METTL14在目标识别中发挥作用,接下来研究R298P突变是否影响m6A修饰模式。 进行了MeRIP-seq分析,通过使用抗m6A抗体进行RNA免疫沉淀,表明大多数目标基因在很大程度上是在METTL14+/+、METTL14+/Mu和METTL14Mu/Mu细胞之间共享(图4A)。所有三种基因型的MeRIP-seq峰在终止密码子周围高度富集(图4B);这种分布模式与之前的MeRIP-seq研究类似,并且R298P突变可能会改变METTL14的靶标识别。
使用exomePeak和MetDiff分析重点关注每个基因型之间差异甲基化的MeRIP-seq峰,进一步分析了突变的METTL14识别基序。exomePeak分析表明,与METTL14Mu/Mu细胞相比,METTL14+/+和METTL14+/Mu细胞中包含的典型基序在甲基化程度更高的峰中显着富集。相反,与METTL14+/+细胞相比,异常5’-AC-3’基序在METTL14Mu/Mu细胞中甲基化程度更高的296个峰中富集。在这296个峰中,m6A-Atlas数据库中注释了512个典型m6A修饰位点。在这些位点中,无论METTL14基因型如何,MeRIP-seq测序的平均深度显著高于所有腺苷,这表明这些典型位点仍可被突变体METTL14(R298P)甲基化(图4D)。相比之下,在METTL14+/Mu样品中,GGAUU和GAAUU基序中腺苷的免疫沉淀测序读数的平均深度显着富集,而在METTL14+/+样品中未观察到这一点。这种富集在METTL14Mu/Mu样品中得到进一步增强(图4D)。此外,MetDiff分析检测到的差异甲基化峰多于exomePeak检测到的峰,表明在METTL14Mu/Mu细胞中甲基化程度较低的峰中再次检测到了包含典型5’-AC-3’的基序,而异常5’-AU-3’基序在METTL14Mu/Mu细胞中甲基化程度更高的峰中富集。综上所述,这些数据表明,尽管METTL14 (R298P)可以在一定程度上识别规范基序,但该突变蛋白也会甲基化异常5’-AU-3’基序中的腺苷。
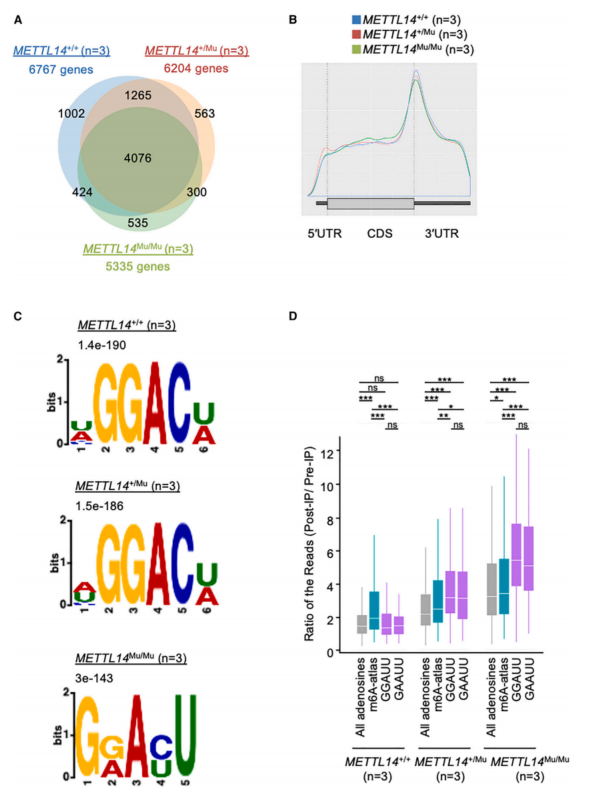
图4 纯合子METTL14 R298P突变诱导的靶标的异常识别
4、尽管m6A修饰减少,但METTL14Mu/Mu细胞中c-Myc mRNA的表达减少
为了识别m6A修饰控制下并参与细胞增殖分子途径的基因,使用基因集富集分析(GSEA)比较了不同METTL14基因型之间的基因表达。该分析表明,与METTL14+/+细胞相比,METTL14+/Mu细胞中原癌基因c-Myc靶向的基因表达水平显着增加(图5A)。c-Myc抑制剂以剂量依赖性方式降低HEC108细胞的活力,表明c-Myc有助于这些细胞的细胞增殖(图5B)。已知c-MycmRNA的表达受到m6A修饰的调控,在MeRIPseq分析中观察到多个甲基化峰,其中包括典型位点(图5C)。为了检查HEC108细胞中c-Myc mRNA的稳定性是否受到m6A修饰的调节,测量了添加放线菌素D(Act.D)抑制转录后c-Myc mRNA的降解率。该分析表明,METTL14+/Mu和METTL14Mu/Mu细胞中的降解率均显著降低(图5D),这表明由于METTL14 (R298P)突变导致的m6A修饰的减少稳定了c-Myc mRNA。
METTL14+/Mu细胞中c-Myc mRNA的表达显着增加,但METTL14Mu/Mu细胞中c-Myc mRNA的表达却下降(图5E)。因此,GSEA显示,与METTL14+/+细胞相比,c-Myc靶向基因的表达水平在METTL14Mu/Mu细胞中显着降低(图5F)。由突变体METTL14 (R298P)识别的异常基序在c-Myc mRNA中未甲基化(图5C)。总的来说,这些数据表明,减少的m6A修饰可以稳定c-Myc mRNA,这可能有利于METTL14+/Mu细胞增殖;而在METTL14Mu/Mu细胞中,c-Myc mRNA表达减少的某种机制很可能主导m6A修饰对c-Myc mRNA的影响。
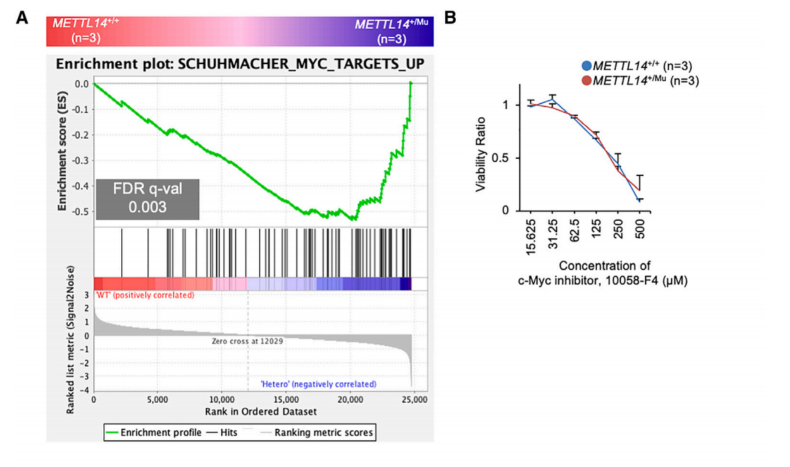
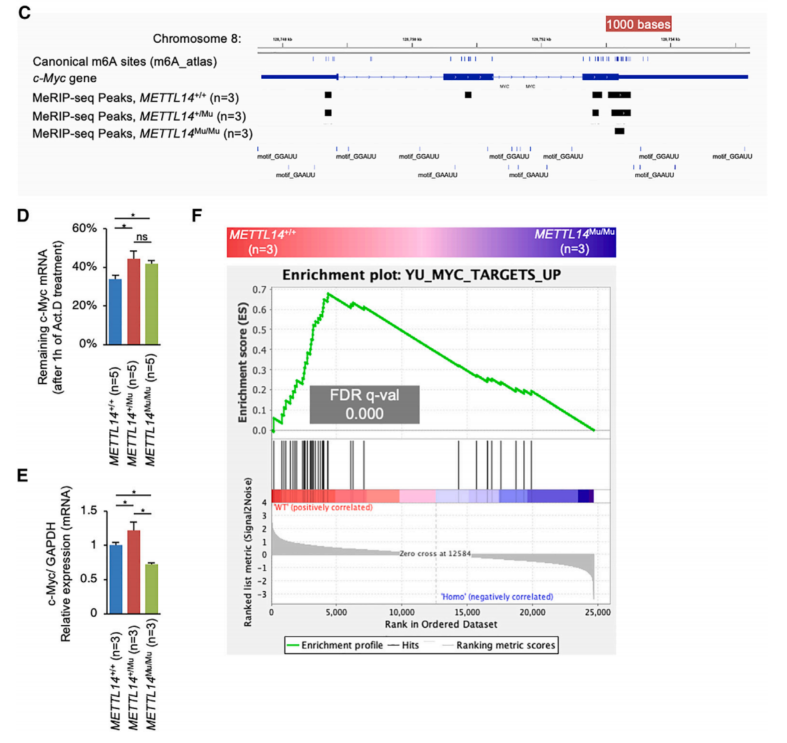
图5 c-Myc mRNA通过METTL14 R298P突变来稳定
5、异常的m6A修饰使c-MET mRNA不稳定,导致c-Myc的表达减少
为研究异常识别基序上的m6A修饰对基因表达的影响,比较METTL14+/+和METTL14Mu/Mu细胞之间包含差异甲基化峰的基因的表达水平。与METTL14Mu/Mu细胞相比,METTL14+/+细胞中甲基化峰值较高的基因显著上调(6A)。进一步将METTL14Mu/Mu细胞中甲基化程度较高的基因(285个基因)分为两个亚组,一组具有典型m6A位点(174个基因),另一组不具有典型m6A位点(111个基因),并分析相应基因的表达,具有典型m6A位点的基因的表达水平显着降低(图6B)。这些数据表明,异常的m6A修饰可能会改变典型基序的甲基化效率,从而影响相应mRNA的稳定性。
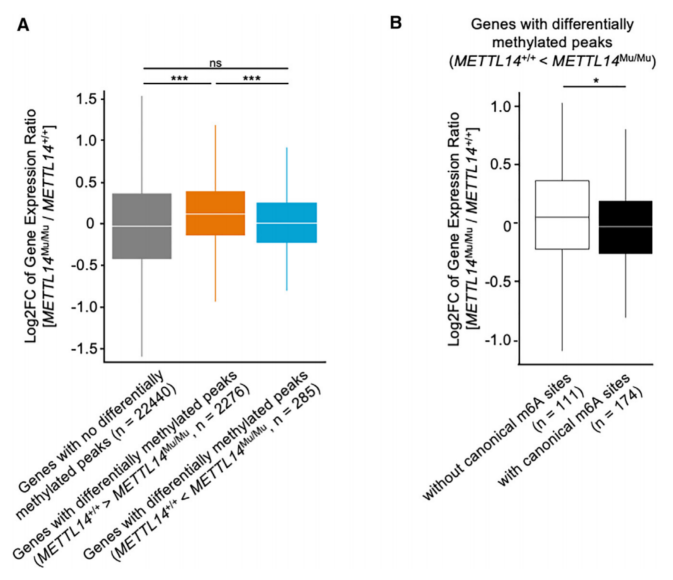
图6 突变体METTL14(R298P)介导的异常m6A修饰降低了典型m6A位点的基因表达
为了找到受异常m6A修饰影响并参与c-Myc上游信号通路的基因,重点关注c-MET,它是一种受m6A修饰调节的原癌基因,已知在子宫内膜癌中发挥着关键作用。GSEA表明,c-MET靶标的表达在METTL14Mu/Mu细胞中显著下调(图7A)。因此,METTL14Mu/Mu中c-MET mRNA的表达显着降低,导致c-MET蛋白表达降低(图7B、7C)。在METTL14+/Mu细胞中未观察到这种改变。为了研究m6A修饰在异常基序中的作用,首先使用c-MET mRNA中含有异常基序(5’-GGAUU-3’)的RNA探针进行电泳迁移率变动测定(EMSA)。该分析表明,与典型基序(5’-GGAUU-3’)中的m6A相比,异常基序中的m6A较少被m6A结合蛋白YTHDF2识别。与METTL14+/+细胞相比,c-MET mRNA异常基序中的腺苷在METTL14Mu/Mu中高度甲基化。与此同时,METTL14Mu/Mu细胞中典型基序周围的腺苷也更加甲基化。
测量了添加Act.D抑制转录后c-METmRNA的降解率。该分析表明METTL14Mu/Mu细胞中的降解率显着增加(图7E)。此外,添加c-MET抑制剂福替尼降低了METTL14+/+和METTL14+/Mu细胞中的c-Myc表达和细胞活力(图7F和7G)。综上所述,靠近异常m6A修饰位点的典型基序的甲基化效率增加,最有可能导致c-MET mRNA的稳定性降低,从而导致c-Myc表达减少,并抑制METTL14Mu/Mu细胞中的细胞增殖。
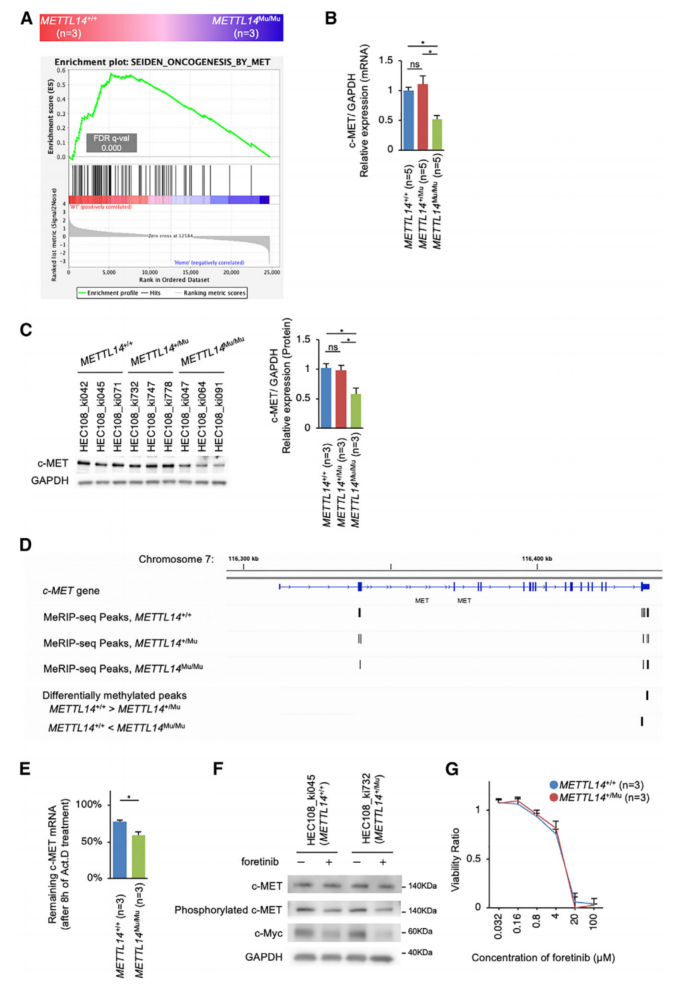
图7 突变体METTL14介导的异常m6A修饰使c-MET mRNA稳定性降低
三、研究结论
METTL14杂合突变促进癌细胞增殖,METTL14纯合突变抑制癌细胞增殖。突变体METTL14诱导异常基序的m6A修饰,异常的m6A修饰会破坏c-MET mRNA的稳定性,从而减少细胞增殖。
参考文献:
A cancer-associated METTL14 mutation induces aberrant m6A modification, affecting tumor growth.[J]Cell Reports, 2023.