| 时间:2024-05-16 |
2023年发表于《Theranostics》(IF =12.4)
一、研究背景
胶质母细胞瘤(GBM)是最常见的颅内原发恶性肿瘤,治疗耐药高,预后差。瘤内细胞高度异质性和可塑性是GBM患者预后不良的主要原因,被分为三种亚型:经典(CL)、原神经性(PN)和间充质(MES)。胶质细胞间充质转化(PMT)是GBM恶性进展过程中放射抵抗和肿瘤复发的主要原因,但胶质瘤干细胞(GSCs)中PMT的分子机制仍不清楚。肿瘤微环境(TME)是肿瘤生长的基础,由免疫细胞、基质细胞、细胞外基质(ECM)、分泌分子等组成。小细胞外囊泡(sEVs)可以从免疫抑制的巨噬细胞转移到GSCs中诱导PMT;然而,MES GSCs(mGSCs)是否也可以反向作用于诱导巨噬细胞免疫抑制仍有待探索。非编码RNAs在肿瘤中发挥重要作用,很多研究表明,LncRNA表达谱可以反映GSCs固有的PN和MES亚型特征,但LncRNAs是否参与GSCs的PMT尚未有相关研究。
本研究中,通过比较PN和MES亚型的GMS和GSCs中差异表达的LncRNAs,发现MIR222HG在MES亚型中高表达。MIR222HG是由miRNA宿主基因(LncMIRHG)产生的一种lncRNA,它可以通过共转录剪接产生多种不同的lncRNA转录本和miRNA-221/222(miR221/222)。在这些产物中,最丰富的LncRNA转录本MIR222HG-201通过将组蛋白H4锚定在GSCs的核中,招募组蛋白脱乙酰酶5(HDAC5)/YWHAE复合体,介导H4K16的脱乙酰化,导致GSCs中的PMT,从而增强辐射抗性。共转录的miR221和miR222可以通过外体从GSC转移到巨噬细胞,介导SOCS3表达的降低,导致巨噬细胞的免疫抑制极化。MIR222HG基因的转录因子SPI1,介导lncRNAs和miRNAs的共转录,导致GSC的PMT和巨噬细胞的免疫抑制极化。最后,证实MES GSCs (mGSCs)对PLX-4720敏感,与放射治疗联合使用可显著提高疗效。
二、研究结果
1、MIR222HG增强胶质瘤干细胞(GSCs)自我更新并调节PMT过程
为了探索可能调节PMT的lncRNAs,利用齐鲁医院神经外科(GEO:GSE211554)GBM测序数据进行分析。将MES-GBM和PN-GBM中的差异表达基因与TCGA中MES-GBM和PN-GBM中的差异表达基因以及ENA中在MES-GSCs和PN-GSCs中差异表达的lncRNAs(PRJEB27943)进行交叉分析。鉴定出7个在MES亚型中高表达的lncRNAs(图1A)。并用qRT-PCR检测了这7个lncRNAs在鼻咽癌和MD Anderson癌症中心的GSC细胞系中的表达(图1B)。MIR222HG最符合预期,在MES-GSCs中的表达高于PN-GSCs,在GSCs中的表达高于NPC。MIR222HG与MES亚型标记基因(CD44、CHI3L1和SERPINE1)的表达呈正相关,与Pn亚型标记基因(DLL3、OLIG2、ASCL1、NCAM1)的表达呈负相关(图1C)。
单细胞RNA-seq分析显示,MIR222HG高表达的细胞团有更高的MES评分。基于Verhaak和Phillips基因组的GSEA显示,MIR222HG在MES亚型中高表达,而MIR222HG在PN亚型中低表达(图1D)。进一步发现MIR222HG主要以MIR222HG-201和MIR222HG-202两种转录本的形式在GBM中表达,其中MIR222HG201的转录本表达最高,MIR222HG主要靠MIR222HG201发挥作用(图1E)。生存分析显示,MIR222HG-201高表达患者预后不良,低表达患者预后良好(图1F)。通过FISH和核质分裂证实MIR222HG是一种定位于细胞核的lncRNA(图1G,H)。神经球形成实验和ELDA结果显示,MIR222HG在mGSC中的敲除显著降低了它们的自我更新能力,而MIR222HG在pGSC中的过表达增强了它们的自我更新能力(图1I,J)。在体内,通过异种移植模型,MIR222HG被证明能显著降低GSC267细胞的成瘤率并延长小鼠的生存时间(图1L)。肿瘤切片免疫组化染色显示CD44表达明显减少,而HE染色显示肿瘤侵袭性明显降低(图1M,N)。相反,过表达MIR222HG增强了GSC8-11细胞的成瘤性和侵袭性,降低了小鼠的存活率和SOX2的表达。综上所述,发现核转录产物MIR222HG-201在MES亚型中高表达,介导PMT过程,增强GSCs的自我更新能力和致瘤性。
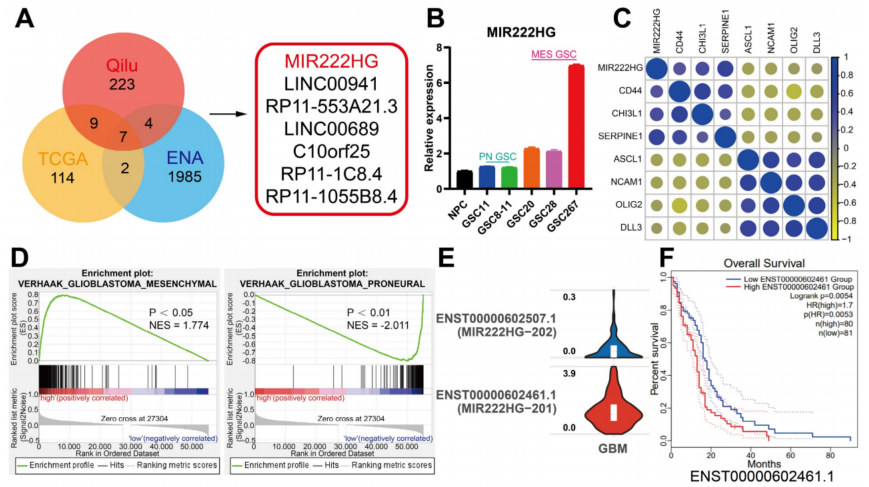
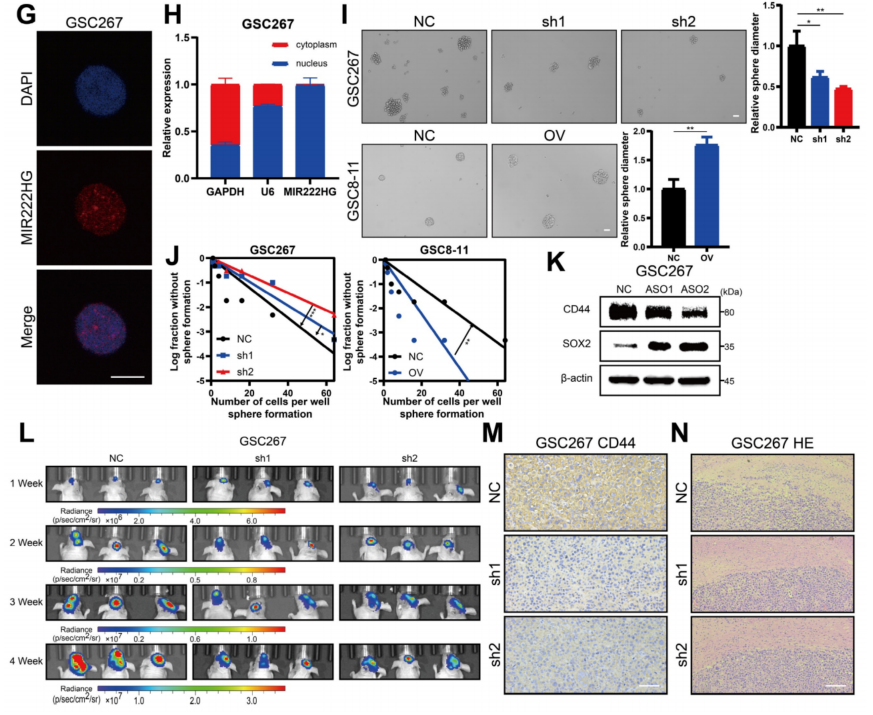
图1 MIR222HG增强了GSC的自我更新,并介导了PMT过程
2、MIR222HG表达与MES GSCs(mGSCs)辐射抗性的关系
由于mGSCs的辐射抗性,GBM患者放射治疗预后很差。为此研究了MIR222HG介导的MES亚型是否在GSC中协调辐射抗性的获得。放射治疗后GSCs出现DNA损伤、G2/M期停滞和细胞凋亡。放射治疗后,mGSCs的细胞凋亡率、G2/M期停滞和DNA损伤较PN GSCs(pGSCs)少。此外,MIR222HG基因在mGSC中的敲除增强了对放射治疗的反应。相反,在pGSCs中过表达MIR222HG可减弱放射治疗的反应(图2A、B、C)。在体内,MIR222HG在mGSCs中的敲除增强了放射反应,减少了肿瘤的形成,并延长了mGSC荷瘤小鼠的生存时间(图2D,E)。小鼠脑切片的HE染色显示,MIR222HG基因敲除联合放射治疗显著降低了肿瘤的侵袭性(图2F)。组织切片TUNEL分析显示,MIR222HG基因敲除可促进体内mGSCs的凋亡(图2G)。相比之下,移植了高表达MIR222HG的pGSCs的小鼠对放射治疗的反应性降低,肿瘤生长更快,放射治疗后生存时间更短。HE染色和原位末端标记法检测现实,高表达MIR222HG的pGSCs并接受放射治疗组的肿瘤侵袭力显著增加、体内肿瘤细胞的凋亡水平降低。综上所述,MIR222HG在体内和体外均增强了mGSCs的辐射抗性。
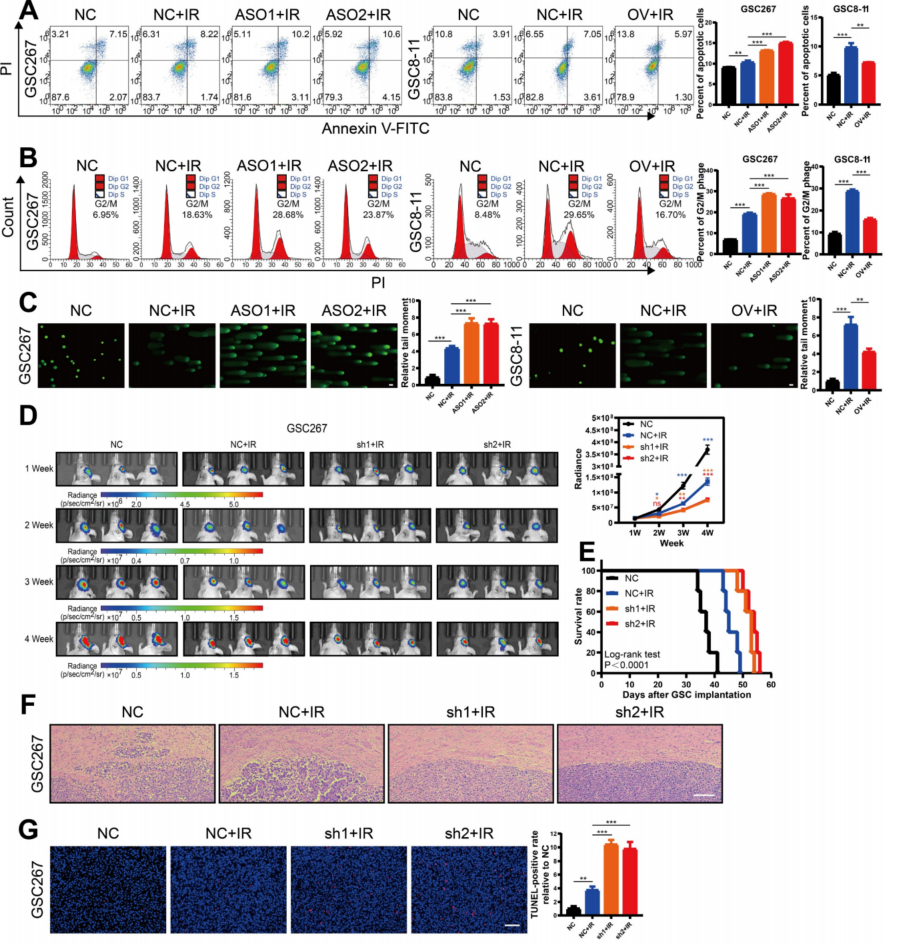
图2 MIR222HG的表达与mGSCs的放射抗性相关
3、MIR222HG介导H4K16脱乙酰基诱导PMT
为了研究核定位的MIR222HG特异性参与PMT的机制,对MIR222HG敲除的GSC267细胞进行了RNA-seq,通过RNA pulldown得到与MIR222HG结合的蛋白质并进行了质谱分析。对RNA-seq的GSEA分析表明,MIR222HG在转录组水平上介导GSC中的PMT(图3A)。核内的lncRNAs可以参与转录水平调节。质谱结果显示,MIR222HG可以与组蛋白H4结合(图3B),没有发现与组蛋白相对应的组蛋白修饰酶。因此,推测在质谱学数据中可能存在参与组蛋白修饰的中间蛋白。STRING数据库预测了与所有剩余的核内蛋白的相互作用,发现只有YWHAE可以与组蛋白修饰酶HDAC5结合(图3C);推测MIR222HG可能通过YWHAE与HDAC5的结合来修饰H4,从而参与PMT。
大量研究表明,组蛋白去乙酰化是促进肿瘤发展的重要因素。HDAC5是一种负责组蛋白去乙酰化的酶,使用GSC267细胞对可能的下游机制进行了一系列验证。使用RNAfold WebServer预测了MIR222HG的二级结构。RNA pulldown结果显示YWHAE与MIR222HG的二级结构2(核苷酸230-750)结合,H4与MIR222HG的二级结构3(核苷酸750-1150)结合(图3D)。再次使用RIP实验验证了MIR222HG与YWHAE和H4的结合(图3E)。Co-IP证实了YWHAE与HDAC5的结合和H4与HDAC5的结合(图3F,G,I)。Western blotting和RNA-seq显示MIR222HG基因被敲除后,YWHAE和HDAC5的表达没有变化,表明MIR222HG不影响细胞内YWHAE和HDAC5的含量(图3J)。
为了确定MIR222HG、YWHAE和HDAC5协同作用于H4的具体位置,我们发现MIR222HG被敲除后,H4K16的乙酰化水平显著增加,表明MIR222HG、YWHAE和HDAC5的联合作用主要导致H4K16的脱乙酰化(图3H)。此外,通过敲低和过表达MIR222HG来检测YWHAE、HDAC5和H4之间的结合亲和力。Co-IP结果表明,MIR222HG基因敲除后,H4与HDAC5的结合亲和力降低;而MIR222HG基因过表达后,H4与HDAC5的结合亲和力增加(图3K,L)。MIR222HG基因敲除或过表达后,YWHAE与HDAC5的结合亲和力没有显著变化,表明MIR222HG不影响YWHAE与HDAC5的结合(图3M,N)。综上所述,这些结果表明,MIR222HG通过二级结构3与H4结合,然后通过二级结构2与YWHAE/HDAC5复合物结合,导致H4K16脱乙酰基。
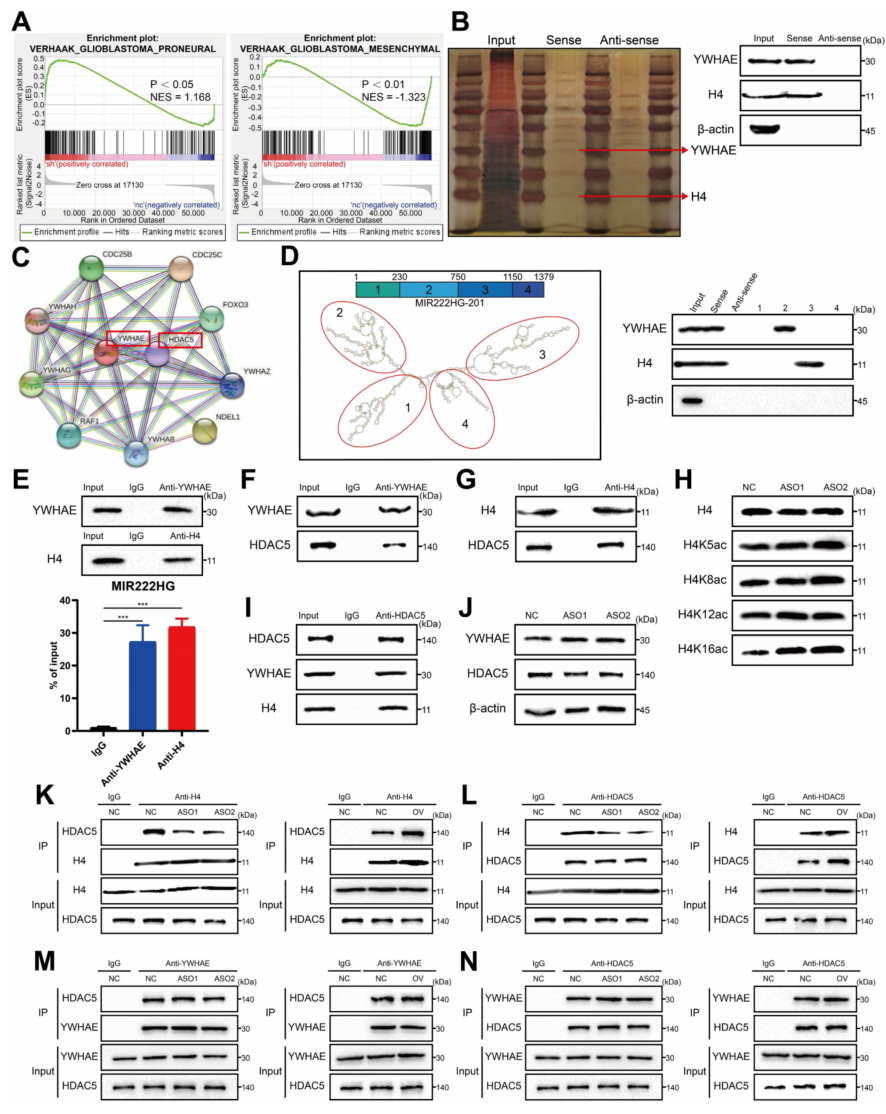
图3 MIR222HG通过介导H4K16去乙酰化来诱导PMT
4、MIR222HG通过H4K16去乙酰化诱导PMT,导致STAT3和MAPK通路激活
接下来,进一步探索了MIR222HG通过YWHAE/HDAC5复合体介导H4K16去乙酰化后下游通路的变化。先前的富集分析表明,MIR222HG的敲除导致了MAPK和JAK-STAT通路的变化(图4A)。STAT3通路已被广泛报道为与MES亚型相关的经典通路,而ERK-MAPK通路已被证明是导致GSCs成为MES亚型的关键因素。
通过干扰MIR222HG复合体中的两个关键蛋白YWHAE和HDAC5来验证下游通路的变化。首先,我们为后续实验选择了最有效的干扰序列(图S3E,F)。Western印迹分析证实,MIR222HG过表达后,P-ERK1/2和P-STAT3水平显著升高,而YWHAE或HDAC5的敲除减弱了P-ERK1/2和P-STAT3的增加,而YWHAE和HDAC5的联合敲除进一步降低了P-ERK1/2和P-STAT3的水平(图4B)。此外,MIR222HG过表达导致H4K16乙酰化增强,CD44表达上调,SOX2表达降低。YWHAE或HDAC5的敲除部分逆转了这些变化,YWHAE和HDAC5的联合敲除进一步逆转了H4K16ac、CD44和SOX2水平的变化(图4B)。MIR222HG的过表达促进了GSC的自我更新,YWHAE或HDAC5的敲除部分逆转了这一变化,YWHAE和HDAC5的联合敲除进一步逆转了这一变化,如神经球形成试验和ELDA所示(图4C)。
细胞凋亡和细胞周期分析表明,过表达MIR222HG后GSCs对放射治疗的抵抗力增加可被YWHAE或HDAC5基因敲除部分逆转,YWHAE和HDAC5基因的联合敲除进一步逆转了GSCs辐射抵抗力的增加(图4D,E)。最后,对所有的GSC和NPC细胞系进行了Western blotting,发现GSC的去乙酰化水平高于NPC,而在GSCs中,MES亚型的去乙酰化水平普遍高于PN亚型(图S3J)。综上所述,MIR222HG通过YWHAE/HDAC5介导H4K16的脱乙酰化,激活STAT3和ERK-MAPK通路,进而导致PMT并增强GSCs的辐射抗性。
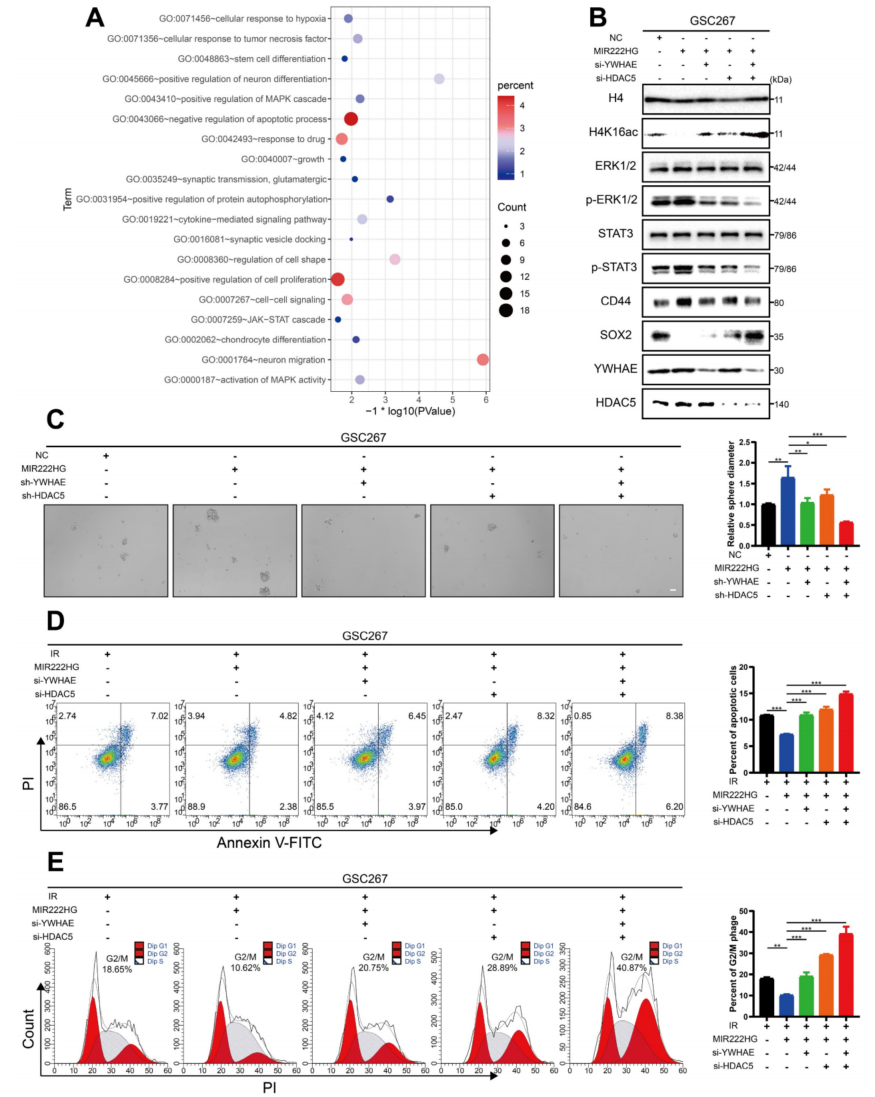
图4 MIR222HG通过H4K16去乙酰化诱导PMT,导致STAT3和MAPK通路的激活
5、miR221和miR222的共转录通过外泌体导致巨噬细胞的免疫抑制状态
已有文献表明,微环境中的肿瘤相关巨噬细胞(TAMs)促进了GBM的恶性进展,而GBM反过来又促进了TAMs的免疫抑制极化。qRT-PCR显示,在mGSC中高表达和在外泌体中也可检测到(图5A)。接下来确定mGSCs是否可以通过外泌体将miRNA-221-3p和miRNA222-3p运送到TAMs来影响巨噬细胞的状态。使用佛波酯(PMA)处理的THP1细胞作为巨噬细胞在随后的实验中进行验证。通过透射电子显微镜、ZetaView分析和western blot鉴定了从GSCs中分离到的外泌体。通过摄取实验,证实了来源于GSCs的外泌体可以被巨噬细胞吞噬。流式细胞仪分析显示,GSCs的外泌体诱导免疫抑制巨噬细胞标志物CD163的表达,并且mGSCs比pGSCs更能诱导外泌体的释放。在巨噬细胞中,用高表达miR221和miR222的GSC8-11细胞的外泌体处理后,CD163的表达比未用GSC8-11细胞的外泌体处理组高。相比之下,用miR221和miR222基因敲除的GSC20和GSC267细胞的外泌体处理后,巨噬细胞中CD163的表达比未经处理的GSC20和GSC267细胞的外泌体处理的降低(图5B)。qRT-PCR检测与流式细胞仪鉴定的结果基本一致(图5C)。这一发现表明,在MGSC中高表达的miR221和miR222可以通过外体作用于巨噬细胞,导致巨噬细胞的免疫抑制极化。
接下来研究了miR221和miR222作用于巨噬细胞的具体机制。已经证明miR221和miR222可以作用于SOCS3来抑制GBM中的血管生成。用ENCORI分析了miR221和miR222序列,发现它们有共同的SOCS3 3’UTR结合位点(图5D)。荧光素酶报告实验验证了miR221和miR222中的SOCS3结合位点(图5E)。Western blot显示,miR221和miR222在巨噬细胞中的过表达降低了SOCS3的表达。对miR221和miR222直接过表达后再过表达SOCS3的巨噬细胞的流式细胞仪分析表明,miR221和miR222的过表达增加了巨噬细胞CD163的表达,而SOCS3的进一步过表达部分逆转了由miR221和miR222过表达引起的CD163表达的增加(图5G)。qRT-PCR与流式细胞仪的结果基本一致(图5F)。最后,验证了miR221和miR222通过SOCS3影响免疫抑制巨噬细胞极化的下游途径。先前的研究表明,敲除SOCS3导致STAT3激活,而抑制NF-κB导致巨噬细胞M2极化。我们发现,miR221和miR222的过表达导致P-STAT3水平升高和P-p65水平下降,而SOCS3的进一步过表达逆转了miR221和miR222过表达所引起的变化。综上所述,这些结果表明,在mGSC中高表达的miR221和miR222可以通过外泌体作用于巨噬细胞中的SOCS3,改变STAT3和NF-κB通路,导致巨噬细胞的免疫抑制极化。
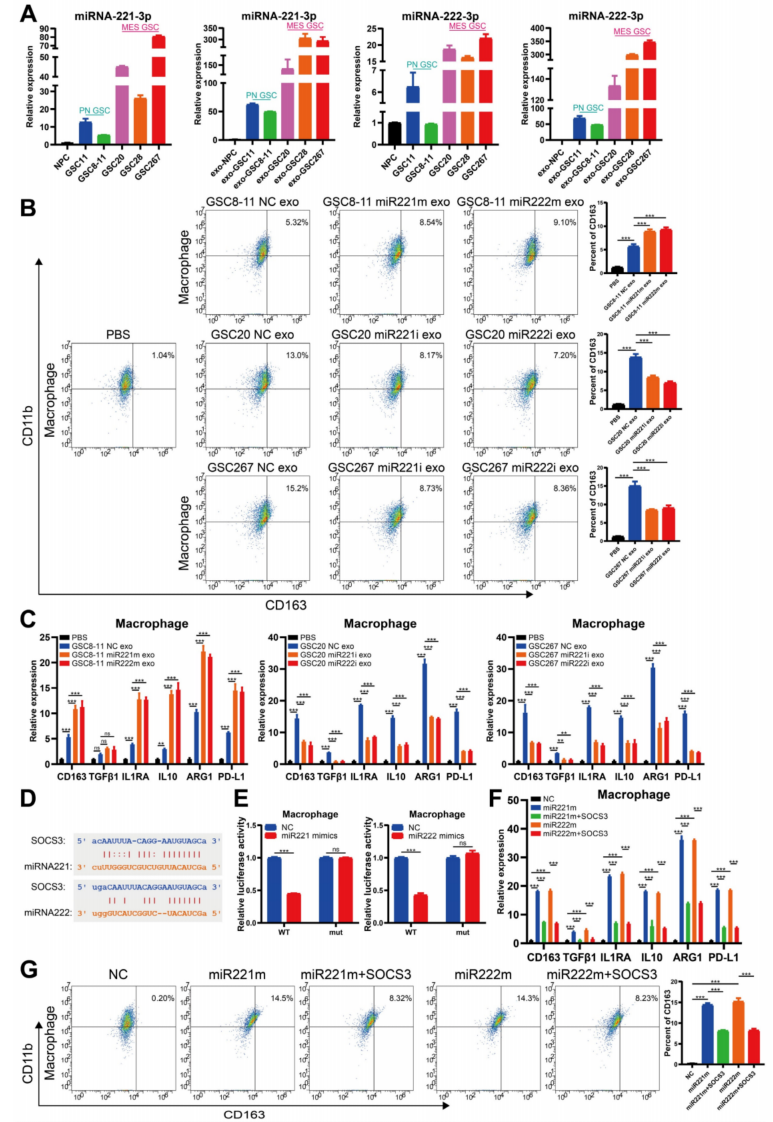
图5 miR221和miR222的共转录通过外泌体导致巨噬细胞的免疫抑制状态
6、转录因子SPI1调控MIR222HG基因的共转录
接下来,进一步研究调控MIR222HG、miR221和miR222表达的共同上游靶点。利用JASPAR预测了MIR222HG基因的转录因子,初步确定了11个潜在的转录因子。然后用生物信息学的方法分析这些转录因子与预后、亚型和免疫特性的关系,并最终以转录因子SPI1为靶点。
SPI1是一种免疫相关的致癌因子,以前主要研究白血病。该研究团队最近发现,SPI1作为一种转录因子促进了GBM的进展,而敲低SPI会减少CD44的表达。基于Verhaak和Phillips基因组的GSEA结果显示,在MES亚型中SPI1的高表达更为普遍,而在PN亚型中SPI1的低表达更为普遍。对MIR222HG可能的转录因子SPI1的序列分析表明,它在MIR222HG基因的上游1613-1632位只有一个结合位点(图6C)。相关分析显示MIR222HG表达与SPI1表达呈正相关(图6B)。荧光素酶报告和芯片分析表明,SPI1通过与MIR222HG基因上游的1613-1632位结合来促进MIR222HG的转录(图6D,E)。SPI1基因敲除后,MIR222HG、miR221和miR222的表达下调(图6A)。接下来,发现SPI1的敲除降低了GSC20和GSC267细胞的自我更新能力,而MIR222HG的过表达逆转了这种变化(图6F,H)。在GSC20和GSC267细胞中,SPI1被敲除后辐射抗性的降低在MIR222HG过表达后被逆转(图6I,J)。Western blot分析显示,SPI1基因敲除后,GSC20和GSC267细胞中H4K16乙酰化水平升高,ERK1/2和STAT3磷酸化水平降低,SOX2表达增加,CD44表达降低,而MIR222HG过表达则逆转了这些变化(图6G)。综上所述,这些发现表明SPI1是一个转录因子,介导MIR222HG、miR221和miR222的共转录,从而引起下游的变化。
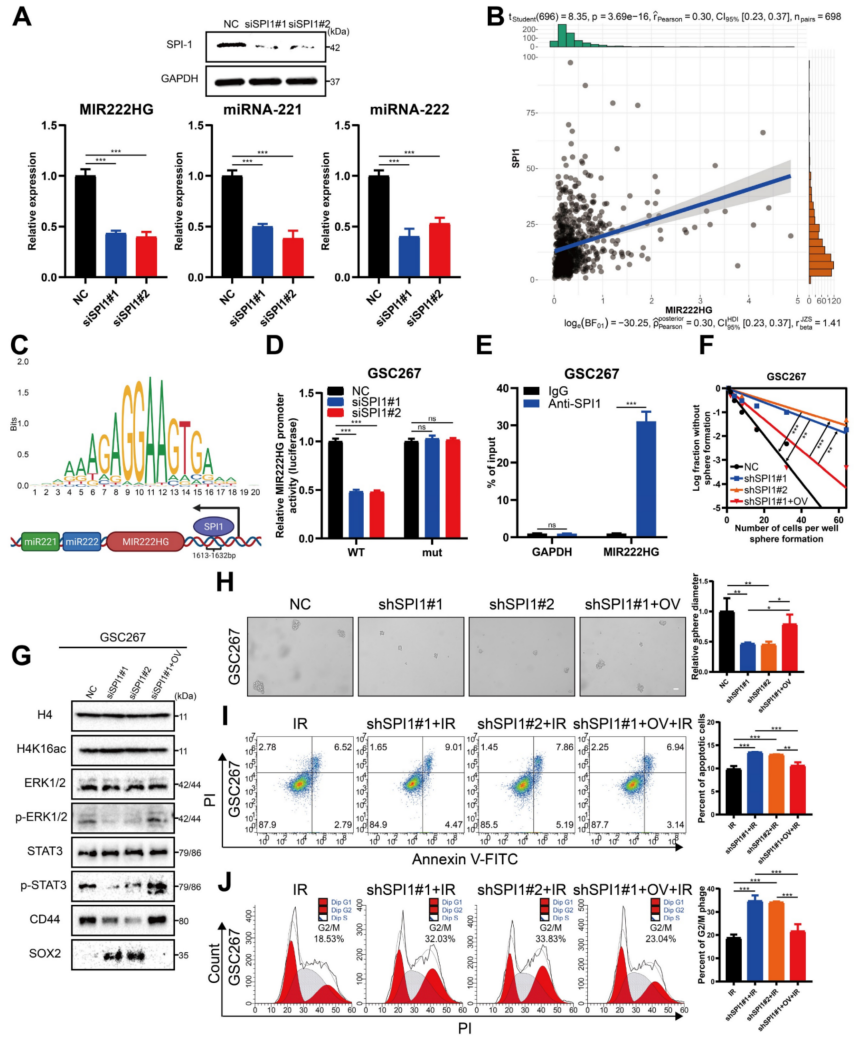
图6 转录因子SPI1调控MIR222HG基因的共转录
7、SPI1表达敏感药物PLX-4720联合放射治疗靶向mGSCs
由于介导MIR222HG转录的SPI1在MES亚型中高表达,因此研究了SPI1的表达与药物敏感性的关系。通过筛选对SPI1高表达的GBM细胞系敏感的药物,并考虑血脑屏障等因素,最终确定了PLX-4720(图7A)。PLX-4720是一种B-Raf抑制剂,已被证明在体外和体内结合放射治疗具有抗GBM的作用。用CCK-8法测定了PLX-4720对GSC20和GSC267细胞的IC50(图7B)。通过用PLX-4720或放疗处理GSC20和GSC267细胞,发现PLX-4720比单纯放疗有更好的疗效,导致DNA损伤增加,细胞凋亡率增加,明显的G2/M期停滞。PLX-4720联合放射治疗可进一步增加GSCs的DNA损伤和细胞凋亡率,并进一步引起GSCs的G2/M期停滞(图7C、D、E)。这些结果表明PLX-4720对放射抵抗的mGSCs有显著的治疗作用。
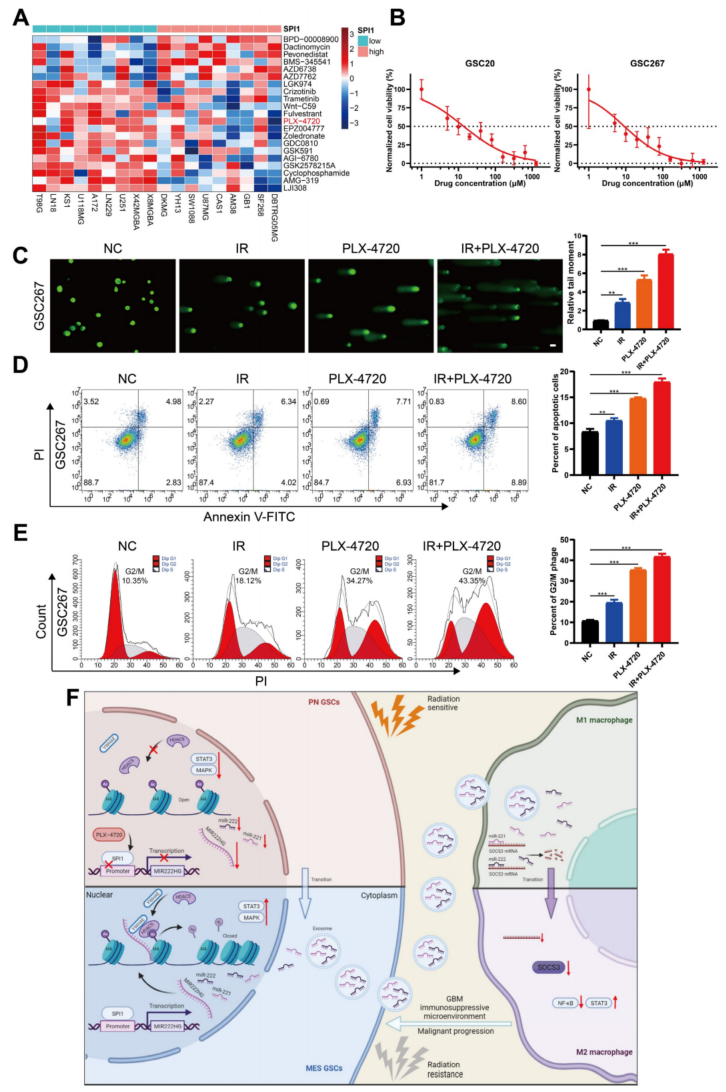
图7 用SPI1表达敏感药物PLX-4720联合放射治疗靶向MGSCs
三、研究结论
SPI1诱导MIR222HG的表达,MIR222HG可以结合到YWHAE/HDAC5复合体上,通过H4脱乙酰基促进GSCs的MES转化。共转录的miR221和miR222可以通过外切体传递给巨噬细胞,靶向SOCS3,导致免疫抑制极化。靶向SPI1阻断MIR222HG簇的转录有助于减少GBM的辐射抵抗和对抗免疫抑制的微环境。PLX-4720是一种潜在的GBM药物和放射增敏剂。
参考文献:
SPI1-mediated MIR222HG transcription promotes proneural-to-mesenchymal transition of glioma stem cells and immunosuppressive polarization of macrophages.[J]Theranostics, 2023.