| 时间:2024-04-23 |
2022年发表于《Theranostics》(IF =12.4)
一、研究背景
胃癌(Gastric cancer, GC)是造成癌症相关死亡的第三大癌种,转移和复发是晚期胃癌患者的主要致死因素,更深入地了解胃癌转移对于临床治疗具有重要意义。脂肪酸结合蛋白4 (FABP4)介导多种生理过程,包括胰岛素敏感性、动脉粥样硬化减弱和炎症反应,FABP4因癌症类型的不同表现出促肿瘤或抗肿瘤作用。例如,乳腺癌中,FABP4通过IL-6/STAT3/ALDH1轴促进肿瘤细胞的干性和侵袭性。此外,一种FABP4小分子抑制剂在卵巢癌小鼠模型中有效阻断了早期转移并减轻了肿瘤负荷。相比之下,FABP4对肝癌细胞具有抗肿瘤作用,并与患者良好的预后相关。迄今为止,FABP4在GC中的报道很少,其在GC中的作用和机制也没有完全阐明。
本研究通过生物信息学分析确定FABP4是转移特异性基因,并揭示了一种新的胃癌转移的分子机制。此外,发现罗格列酮可以有效的干预GC中FABP4,表明FABP4是一种新的诊断和治疗的潜在靶点。
二、研究结果
1、胃癌患者中,FABP4的下调与生存率降低和复发率增加有关
为了探索预测GC转移的特异性生物标志物,对20例有/无腹膜转移(PM)或复发的患者样本进行了RNA-seq,鉴定出部分差异表达基因。随后,使用TCGA-STAD数据集缩小候选基因列表,并确定了5个重叠的生物标志物(FABP4, FHL1, LARGE2, ASCL2和VIL1),FABP4是在癌症中被研究得最广泛的基因,并且只有FABP家族只有FABP4的表达有显著性差异。因此,选择FABP4进行后续实验(图1A)。免疫组化(IHC)染色数据(图1B)证实,FABP4在腹膜转移(PM)的GC患者中下调。
与正常胃组织相比,在GC中的FABP4 mRNA(图1C-D)和蛋白水平(图1E-F)均显著降低。此外,系统地评估了GC患者组织标本中FABP4水平的预后意义(n = 352)。正常组织中检测到强烈的FABP4阳性信号,而肿瘤组织中FABP4信号明显降低(图1G-H)。临床病理分析表明,FABP4低表达患者的预后比FABP4高表达患者差,多因素Cox回归分析显示,FABP4表达是胃癌患者总生存的独立预后因素。此外,分析了胃切除术的胃癌患者复发模式与FABP4表达的关系。结果证实,低FABP4表达与淋巴结、肝脏、腹膜和整体复发模式显著相关(图1I)。FABP4低表达组的累积总复发率大于FABP4高表达组(图1J)。并用另外的序队列(n = 123)进行了验证。这些数据表明FABP4表达与胃癌复发和患者预后相关。
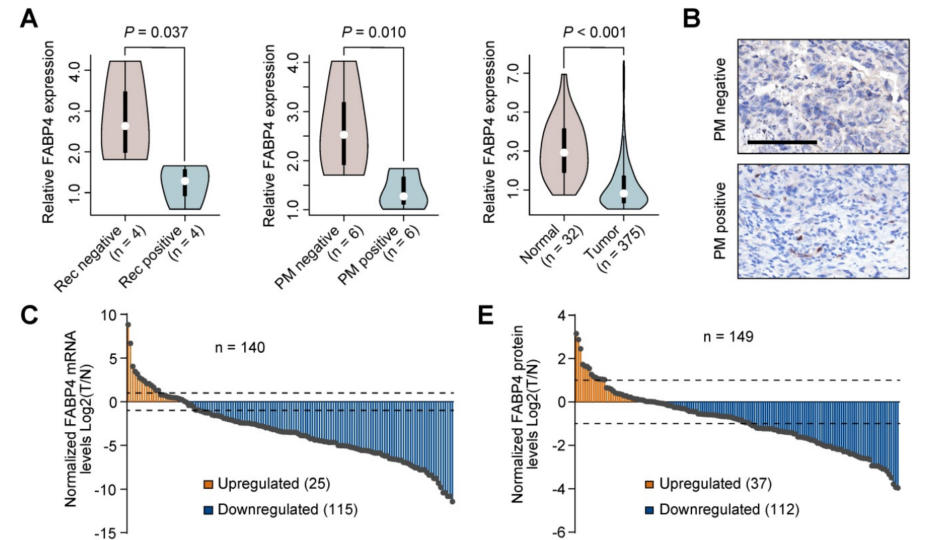
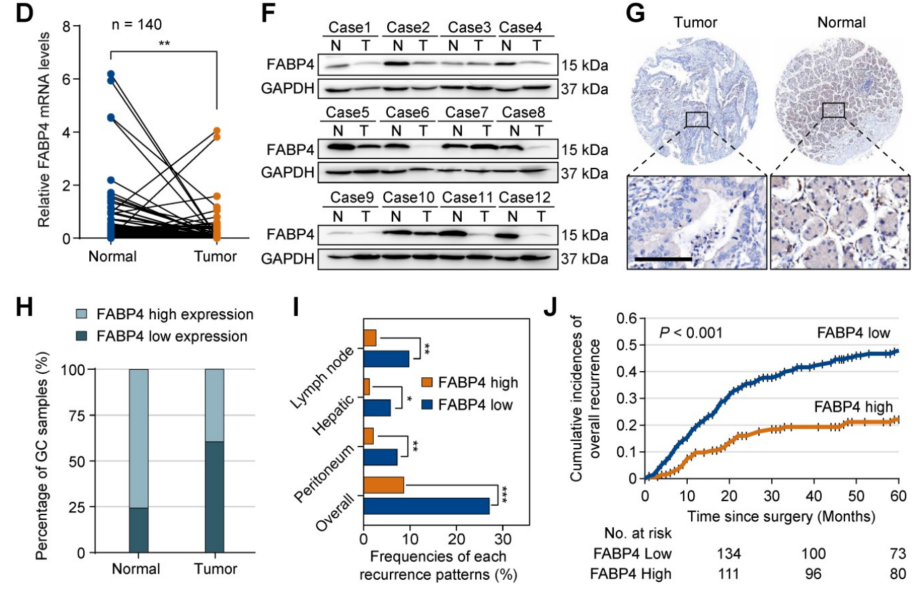
图1 FABP4在人胃癌中的异常表达及其临床意义
2、FABP4在体内和体外均能抑制胃癌转移
在人胃癌细胞系(AGS、BGC-823和MGC-803)中,通过稳定过表达或低表达FABP4来评估FABP4对恶性肿瘤的影响。同时,以FABP5为阴性对照,观察到FABP5的表达无明显变化,而异位表达FABP4可显著抑制GC细胞的迁移和侵袭。相反,抑制MGC-803和AGS细胞中FABP4的表达会产生相反的效果。然而,FABP4的过表达或敲低并不影响体外GC细胞的增殖或凋亡。
为了进一步验证FABP4在体内对转移的影响,建立了肺转移模型。研究发现,上调FABP4可抑制胃癌细胞的转移(FABP4过表达的小鼠肺部转移菌落数量明显低于未过表达的小鼠)(图2A-B),而下调FABP4表达可增加转移(图2C-D)。此外,将GC细胞注入裸鼠脾脏,诱导肝脏转移灶的形成。对解剖肝脏的检查显示,FABP4过表达组的肿瘤灶数量少于对照组(图2E),而FABP4敲低导致相反的趋势(图2F)。在皮下植入的GC肿瘤模型中,与体外实验结果一致,FABP4对异种移植物的生长没有影响。综上结果表明FABP4作为胃癌转移的强抑制因子,但不促进肿瘤生长。
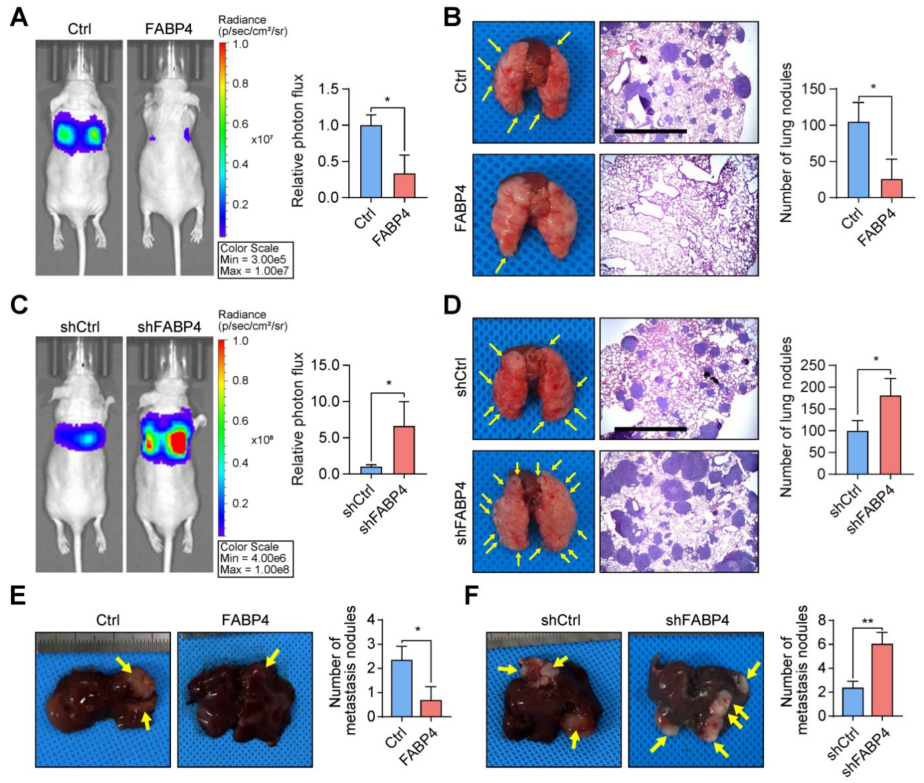
图2 FABP4可显著抑制GC细胞的转移能力
3、CADM3是FABP4的关键功能相关靶点
对FABP4高表达和低表达的人GC样本进行了RNA-seq,发现细胞粘附基因CADM3的水平与FABP4的水平大多呈显著正相关(图3A)。接下来在公共数据库TCGA和GSE15459中进行验证;另外的36个GC标本的qPCR,进一步证实了FABP4与CADM3之间的正相关(图3B)。免疫组化分析结果证实,在两个独立队列中,FABP4低表达组的CADM3水平降低(图3C)。对TCGA-STAD和GSE15459数据集的分析也得到了类似的结果(图3D)。
以往的研究表明CADM3与肿瘤发生有关,在胶质瘤和其他几种类型的癌症中显示出肿瘤抑制特性;并且本研究中的CADM3低表达患者的预后比CADM3高表达患者差。为了研究FABP4的抗肿瘤作用是否由CADM3介导,构建了CADM3真核表达载体,并使用靶向CADM3的siRNA (siCADM3);并将CADM2/4作为阴性对照。结果显示,CADM2/4无明显变化(图S5E-F);CADM3的表达抑制了GC细胞的迁移和侵袭,而siCADM3增加了GC细胞的迁移和侵袭。进一步关于CADM3在FABP4相关转移中的作用的挽救实验显示,无论是在敲低FABP4的情况下重新引入FABP4,还是在CADM3过表达的情况下破坏FABP4, GC细胞的侵袭能力都没有显著差异,说明CADM3可能是FABP4的下游。
FABP4和CADM3存在着一种转录调控机制,ChIP-seq结果显示FABP4在CADM3启动子存在结合,但在CADM3的启动子区域不富集,这表明FABP4不能直接促进GC中CADM3的转录(图3E)。此外,基因集富集分析(GSEA)结果表明,在FABP4高表达的GC样品中,最显著上调的分子包括过氧化物酶体增殖物激活受体(PPAR)信号通路相关基因集(图3F)。
PPAR是一组依赖配体的核转录因子,包括PPAR-α、PPAR-β和PPAR-γ。为研究PPAR亚型是否会影响CADM3的表达,使用多种PPAR激动剂的实验结果表明,PPAR-γ激动剂罗格列酮显著增加CADM3的表达,而其他激动剂对CADM3的表达没有影响(图3G)。这些数据表明CADM3是介导FABP4在GC中起保护作用的关键分子。因此假设PPAR-γ转录因子可能有助于CADM3的表达。
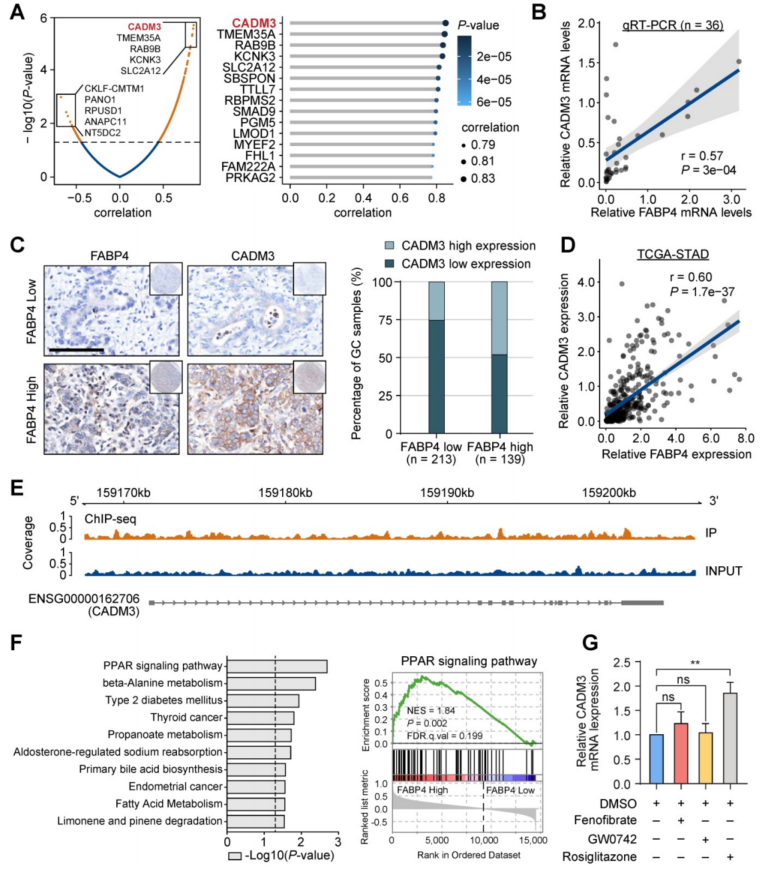
图3 CADM3作为FABP4的功能相关靶点的鉴定
4、FABP4促进核受体PPAR-γ调控的CADM3表达
使用STRING数据库进行分析表明,FABP4可以与PPAR-γ相互作用。PPAR-γ通常作为配体依赖性转录因子调节下游靶基因,因此假设FABP4是PPAR-γ的配体,并且与PPAR-γ的直接结合介导了FABP4相应的生物学作用。 Co-IP结果表明FABP4和PPAR-γ有相互作用,异位表达的3Flag-FABP4被内源性PPAR-γ在GC细胞中免疫沉淀(图4A)。免疫荧光法分析显示FABP4诱导PPAR-γ从细胞质转移到细胞核。
Western blotting检测结果显示,GC细胞中FABP4上调导致PPAR-γ表达增加(图4C)。过表达FABP4显著延长PPAR-γ的半衰期(图4D)。此外,使用肽醛蛋白酶体抑制剂MG132的实验结果表明,FABP4降低了内源性PPAR-γ的降解(图4E)。此外,罗格列酮在mRNA和蛋白水平上影响CADM3表达的时间和剂量依赖性(图4F-G)。然而,FABP4的表达不受罗格列酮处理的影响(图4G),这表明PPAR-γ介导FABP4对CADM3表达的调节。
然后,为研究了PPAR-γ是否在转录水平上直接调节CADM3的表达。从UCSC Genome Browser和JASPAR转录因子数据库检索到的CADM3启动子序列显示存在PPRE区域的结构特征(图4H)。双荧光素酶报告基因检测结果表明,CADM3启动子被PPAR-γ激活(图4I),而FABP4促进了这一作用(图4J)。综上可知,FABP4作为配体与转录因子PPAR-γ结合,并增强其转录活性,直接促进了CADM3在GC中的表达。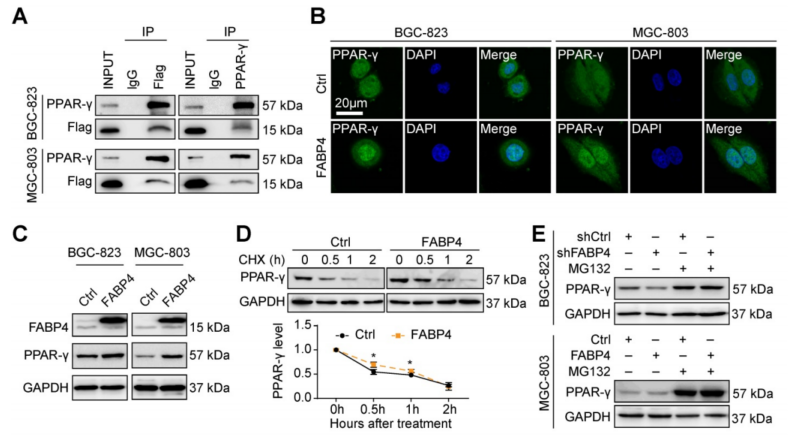
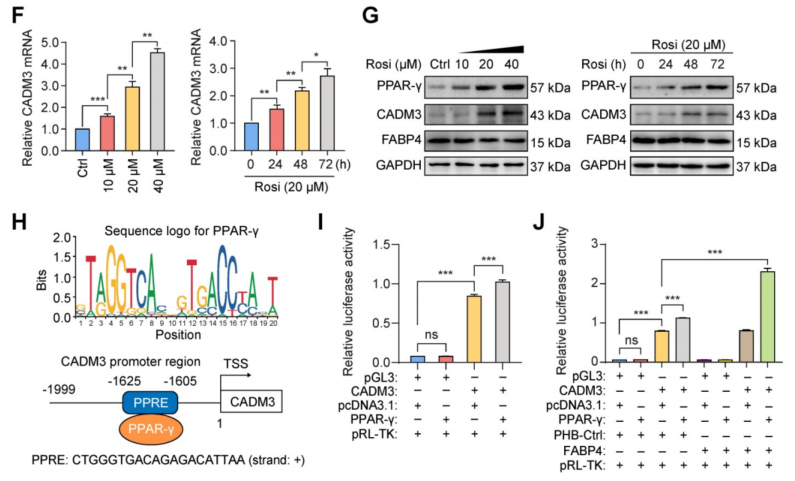
图4 FABP4促进PPAR-γ介导的CADM3转录
5、罗格列酮是治疗FABP4缺陷胃癌的潜在抗肿瘤药物
为了验证FABP4介导的胃癌转移的分子机制,在MGC-803胃癌细胞中进行了一系列的拯救实验。结果表明,在转染PPAR-γ siRNA的细胞中,FABP4诱导的GC细胞中CADM3表达上调和对侵袭和迁移的抑制减弱(图5A)。重要的是,罗格列酮有效地逆转了FABP4敲低引起的CADM3下调和GC细胞的侵袭性特征(图5B)。
接下来进行了体内实验,建立了BALB/c裸鼠模型,通过尾静脉注射给药,使其携带来自FABP4缺陷BGC-823细胞的肿瘤;这些动物腹腔注射罗格列酮或载体DMSO。生物发光成像分析结果表明,与DMSO治疗相比,罗格列酮治疗显著抑制肿瘤转移(图5D-E)。第28天对荷瘤小鼠肺的检查显示,罗格列酮治疗显著减少了转移克隆的数量(图5F-G)。并将这些细胞注射到裸鼠脾脏,建立肝转移模型(图5H)。20 mg/kg罗格列酮组肝组织切片转移灶数量减少(图5I-J),预后较对照组好(图5K)。总之,这次结果表明罗格列酮在体内和体外逆转了FABP4缺陷胃癌细胞转移能力的变化。
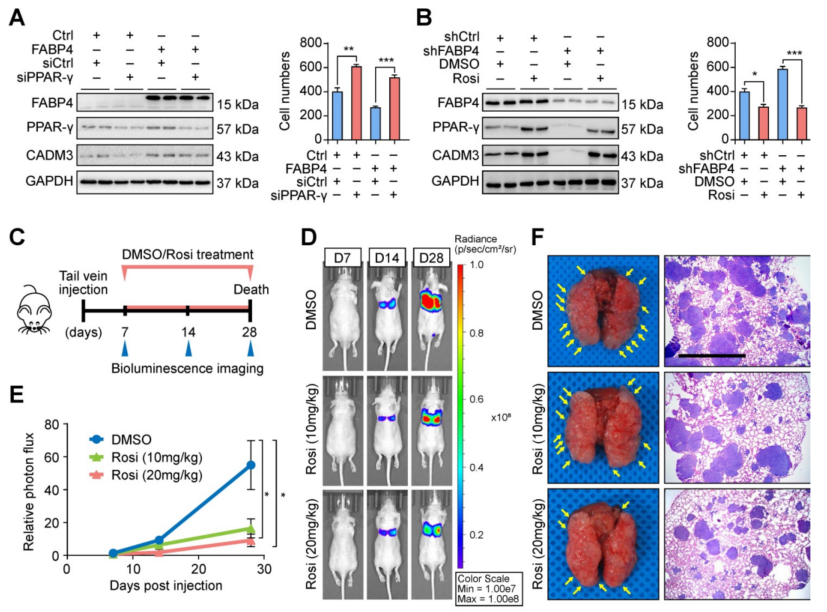
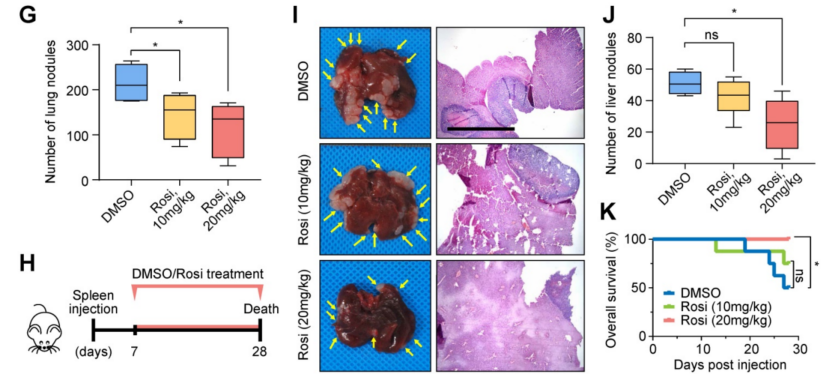
图5 罗格列酮可逆转体内外FABP4缺陷GC细胞的转移能力
6、罗格列酮治疗与胃癌患者复发风险的相关性
为了评估罗格列酮治疗是否与根治性胃切除术后胃癌复发相关,收集了胃癌患者使用降糖药物的额外信息。在352例GC患者中,23例(6.5%)患者诊断为糖尿病,其中5例(21.7%)患者接受了罗格列酮治疗(图6A)。相比未接受罗格列酮治疗的患者(n = 13), FABP4低表达患者接受罗格列酮治疗后的复发率更低或生存率更高(n = 3)(图6B)。然而,FABP4高表达的患者并没有从罗格列酮给药中获益(图6C),这意味着罗格列酮的抗肿瘤作用在个体之间是不同的。

图6 罗格列酮对FABP4低表达患者的潜在抗肿瘤作用
7、染色质不可及性可能通过HDAC1过表达导致FABP4表达减少
由于与正常组织相比,在GC组织中检测到FABP4表达下调,为探究FABP4失调的原因,使用cBioPortal分析了TCGA数据集中FABP4变异的频率和类型,分析表明拷贝数变异(CNV)或突变不是导致FABP4表达改变的主要原因(图7A-B)。此外,FABP4的表达与其启动子的甲基化无关,MethPrimer分析未发现高甲基化的CpG位点。
通过ATAC-seq意外发现FABP4在GC组织中具有低染色质可接近性(图7C),这意味着FABP4在GC中的低表达可能是由染色质可接近性降低引起的。考虑到组蛋白去乙酰化酶(HDAC)的活性与染色质可及性和基因的异常表达密切相关,分析了TCGA和GSE15459数据集中HDAC与FABP4之间的相关性。只有HDAC1的表达与FABP4的表达显著相关(图7D)。添加HDAC抑制剂LAQ824后显示,HDAC1表达受到抑制,FABP4表达增加,而其他HDACs的表达水平无明显变化(图7E)。匹配的散点图显示,HDAC1与FABP4、HDAC1与CADM3在GC组织中的表达呈比例相关。在475个GC标本的两个独立队列中证实了HDAC1与FABP4以及HDAC1与CADM3之间的负相关(图7F-G)。综上所述,这些结果表明FABP4在GC中的表达下调是由可及性降低引起的,并与HDAC1相关。
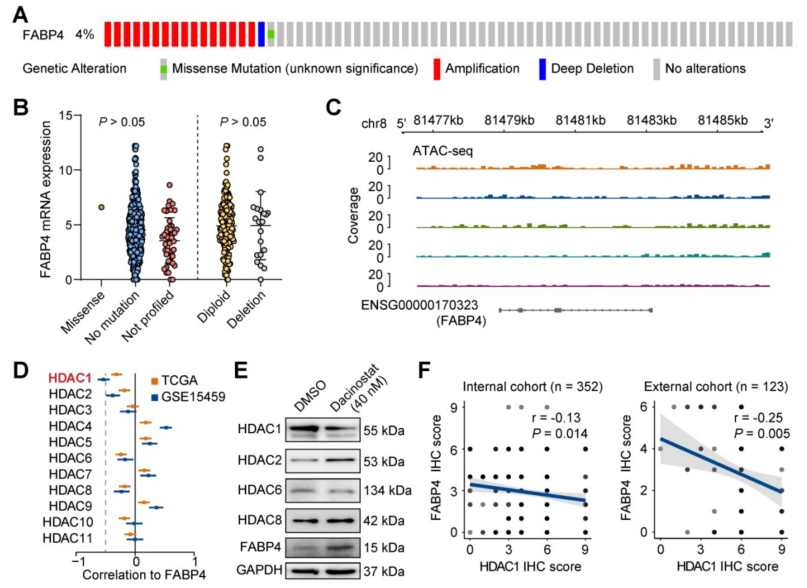
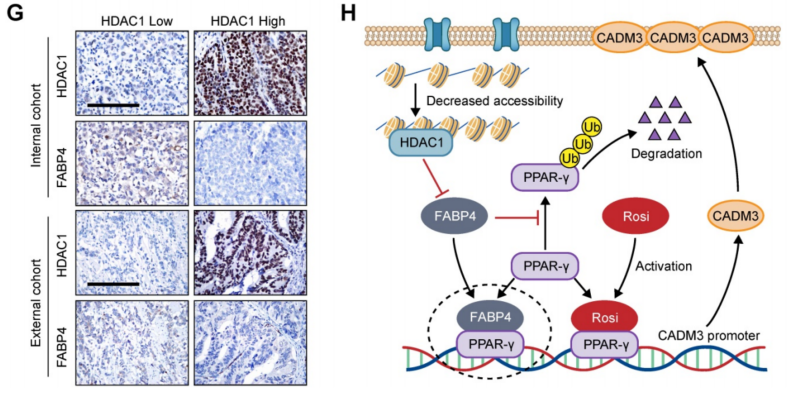
图7 FABP4表达的降低可能与HDAC1介导的染色质不可接近性有关
三、研究结论
染色质可及性降低导致FABP4表达减少,从而通过PPAR-γ抑制CADM3转录,从而导致胃癌转移。降糖药物罗格列酮可恢复FABP4缺陷GC中PPAR-γ/CADM3的激活,具有良好的临床治疗潜力。
参考文献:
The peroxisome proliferator-activated receptor agonist rosiglitazone specifically represses tumour metastatic potential in chromatin inaccessibility-mediated FABP4-deficient gastric cancer.[J]Theranostics, 2022.