| 时间:2024-04-10 |
2022年发表于《Hepatology》(IF =14.0)
一、研究背景
肝细胞癌(HCC)已成为全球癌症相关死亡的主要原因,随着高通量测序的发展,发现TERT启动子、CTNNB1和TP53的突变是驱动癌症发展的主要原因。p53突变体具有促癌表型,包括增强细胞增殖和存活、上皮-间质转化、细胞凋亡逃避、体内肿瘤启动能力等。L3区域的结构突变可能会极大地扰乱L3环,导致高灵活性,有利于替代构象,对整体蛋白质稳定性和DNA结合产生严重后果。TP53R249S突变是HCC特有的热点错义突变,已被证明与细胞系中细胞增殖增强和克隆原性等致瘤行为相关。
本研究为评估TP53突变的潜在转录活性,通过ChIP-seq研究了四种同时存在TP53缺失和DBD突变的患者来源的HCC细胞系,包括两个L3环突变(TP53R249S/−和TP53S241F/−)和两个非L3环突变(TP53H168R/−和TP53L145R/−);并与H3K27ac的ChIP-seq进行了整合分析。利用CRISPR建立了TP53KO和TP53R249S人类肝脏类器官模型,揭示了TP53 缺失导致抑癌功能的丧失和TP53的L3的获得性功能突变,促进了肝细胞癌的发生和进展。
二、研究结果
1、ChIP-seq揭示了L3突变体在染色质重塑和应激反应中的GOF作用
很多研究已表明,突变的p53蛋白可能是一组具有不同GOF活性的变异癌蛋白。为了系统地评估肝癌中TP53错感突变对转录激活的潜在影响,利用ChIP-seq对TP53和H3K27ac进行了分析。对四种TP53突变进行了ChIP-seq,包括两种L3环突变(TP53R249S/−和TP53S241F/−)和两种非L3环突变(TP53L145R/−和TP53H168R/−)。发现在这四种突变体中,与WT TP53相比,常规TP53转录活性的丧失是很常见的(图1E)。
为了确定TP53突变体的功能本体,使用靠近这三组TP53结合峰(即WT TP53相关峰、L3环相关峰和TP53R249S/−显性峰)的基因进行通路富集分析。WT TP53主要参与细胞凋亡、细胞周期和DNA损伤的调节(图1Gi),这印证了TP53在HCC中的抑瘤作用。TP53突变体表现出不同的调控活性。L3环突变体与染色质重塑和生物合成过程相关的基因结合(图1Gii),而TP53R249S/−中独有的富集,包括应激反应和蛋白质修饰(图1Giii)。
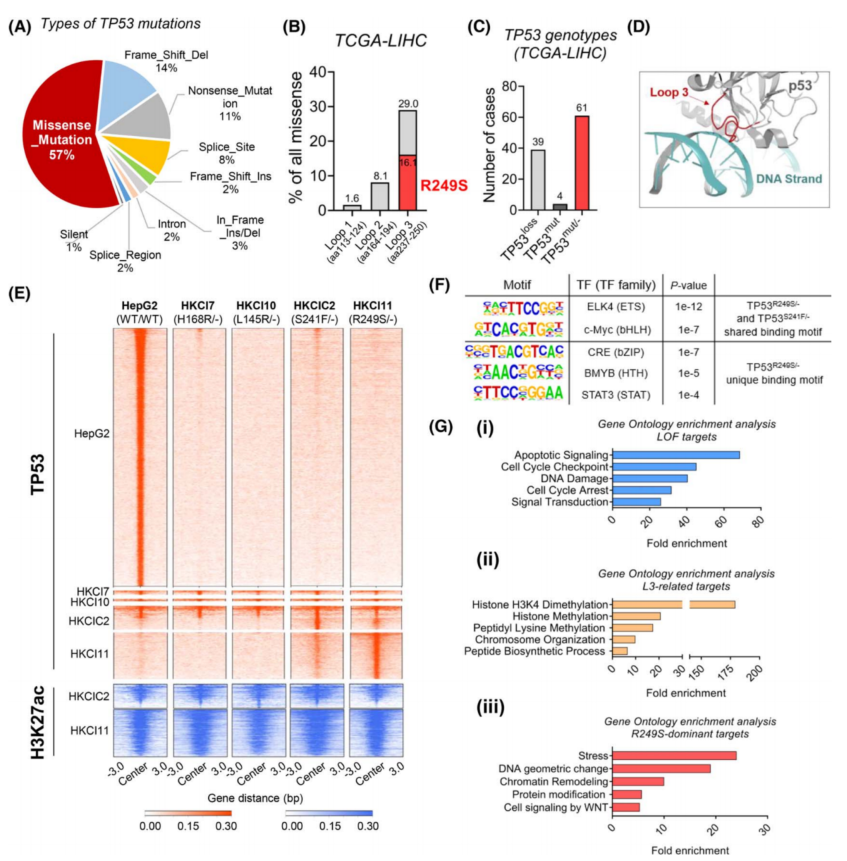
图1 TP53基因型的染色质免疫沉淀测序(ChIP-seq)
为了证实ChIP‐seq对L3突变体新结合位置,在HepG2 (TP53WT/WT)、HKCIC2(TP53S241F/−)和HKCI11 (TP53R249S/−)细胞中进行了ChIP-qPCR,以验证TP53突变体与富集靶标的转录起始位点(TSS)区域的直接结合。与TP53S241F/−和TP53WT/WT相比,TSS区域都显示出显著的TP53R249S/−结合富集(图2Ci,Cii)。在配对HCC和邻近非肿瘤肝脏的独立原发性队列中进行了验证,证实了L3突变体增强了基因表达。在TP53L3环突变的标本中,L3环靶点明显升高(图2E)。
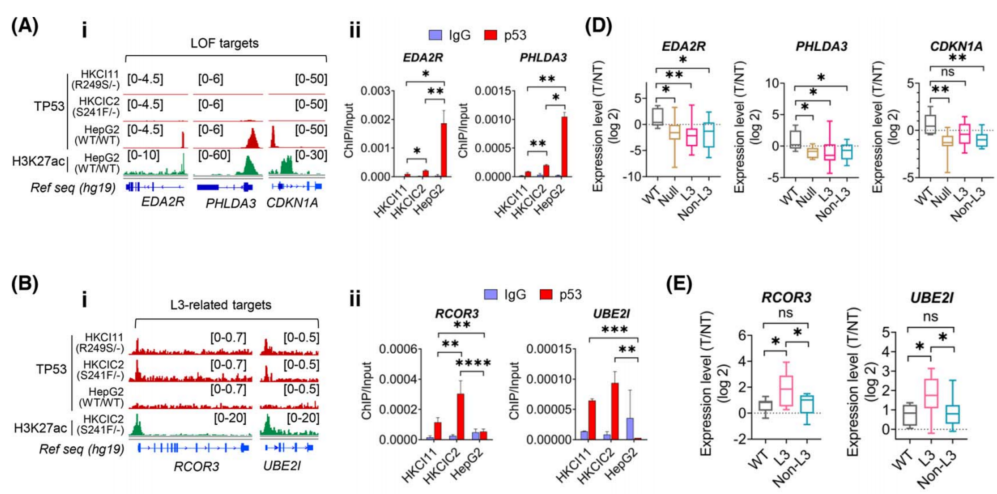
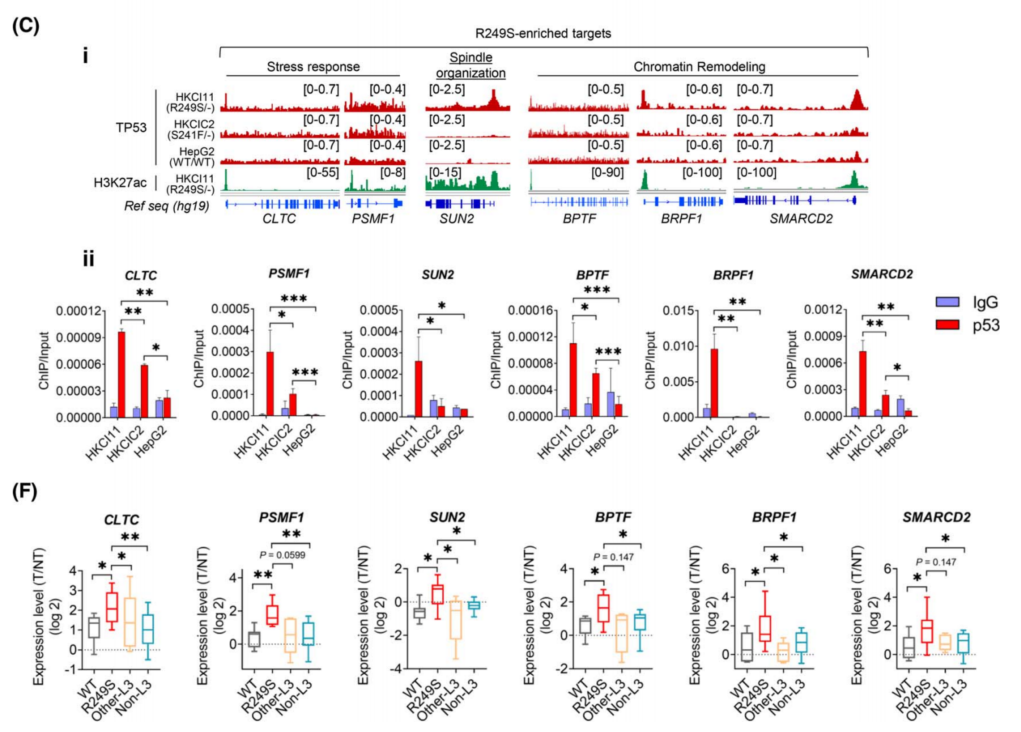
图2 功能缺失(LOF)、L3环和R249S富集靶标的验证
2、TP53 KO和R249S产生原发性肝类器官和致瘤诱导
为研究TP53KO和TP53R249S在HCC中的癌启动作用,开发了三个肝类器官(图3A)。肝脏祖细胞标志物CK19和EpCAM以及肝细胞标志物HNFα在缺乏肝癌指标GPC3 的情况下高表达,表明这些类器官在非肿瘤状态下起源于肝脏;全外显子组测序也支持这一结果。 说明构建的肝脏类器官模型适用于下游基因编辑研究。
为了模拟TP53R249S/−基因型,利用CRISPR/Cas9系统应用于三个肝类器官中TP53的KO (图3B)。随后用pLV-Hygro-TP53R249S慢病毒过表达相应的TP53R249S(图3B)。形态学上,从明场成像和组织学染色来看,WT (TP53WT)肝类器官在单层腔室中保持均匀性(图3D)。而TP53KO和R249S过表达(TP53R249S)的类器官表现出不同的形态,其中壁增厚内陷到管腔中,并呈现多形性恶性特征(图3D)。肝脏延时成像也观察到了WT和TP53KO、R249S过表达的形态差异(图3E)。与组织学一致,单层类器官在TP53WT组中很常见,而在TP53KO和TP53R249S肝脏中广泛可见多层或异常增生的肿瘤样器官。
此外,所有TP53WT对照类器官在20代内停止生长(图3G)。TP53KO和TP53R249S类器官在繁殖过程中都继续增殖和扩大,在50传代以上,分裂率保持在每周1:4的一致(图3G)。同时评估了肝癌干细胞标志物CD44和CD133在三个肝类器官中的表达。与TP53WT对照相比,TP53KO和TP53R249S类器官中CD44和CD133的表达显著增加(图3H),表明癌症相关的干性能力受到显著刺激。
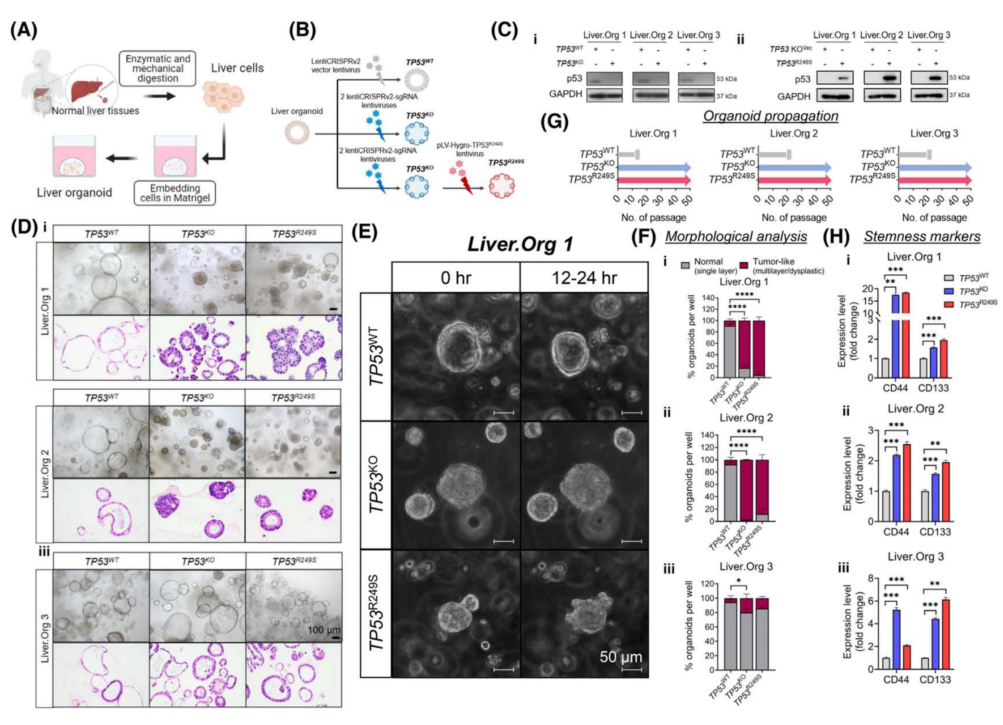
图3 TP53KO和TP53R249S肝类器官表现为癌前病变。
3、模拟肝脏类器官中TP53R249S引发肿瘤
首先验证了TP53 LOF靶基因和R249S显性候选基因的表达,这些基因与编辑后的肝类器官的应激反应和梭形组织有关。与原发性HCC中发现的表达一致,检测到R249S 显性靶点在R249S 过表达的肝类器官中显著上调(图4A)。与TP53 WT对照相比,两种与应激相关的R249S显性靶点CLTC和PSMF1的启动子活性在TP53 R249S表达细胞中明显升高(图4B)。锚定非依赖性实验表明,TP53R249S类器官中存在明显的大致密球体,而TP53KO类器官中存在球状簇,而对照类器官中只有微小的零星球体(图4C)。TP53R249S的致瘤潜能在异种移植中得到进一步证实,R249S过表达的肝类器官(37%)的病变形成增加(图4D)。p53的缺失和R249S突变的增加同时发生了恶性转化。
使用不同的应激特异性刺激剂,研究了R249S相关的应激反应在肿瘤处置中的作用。TP53R249S只对衣霉素有明显的耐受性,而对其他诱导剂没有明显的耐受性(图4F)。敲除PSMF1的可以恢复肝类器官对衣霉素的自发敏感性(图4I);PSMF1通过阻止UPR激活来缓解内质网应激(图4J)。
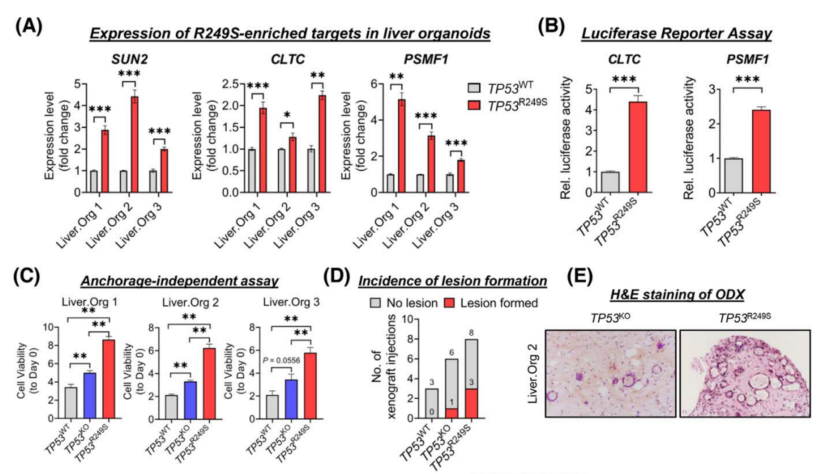
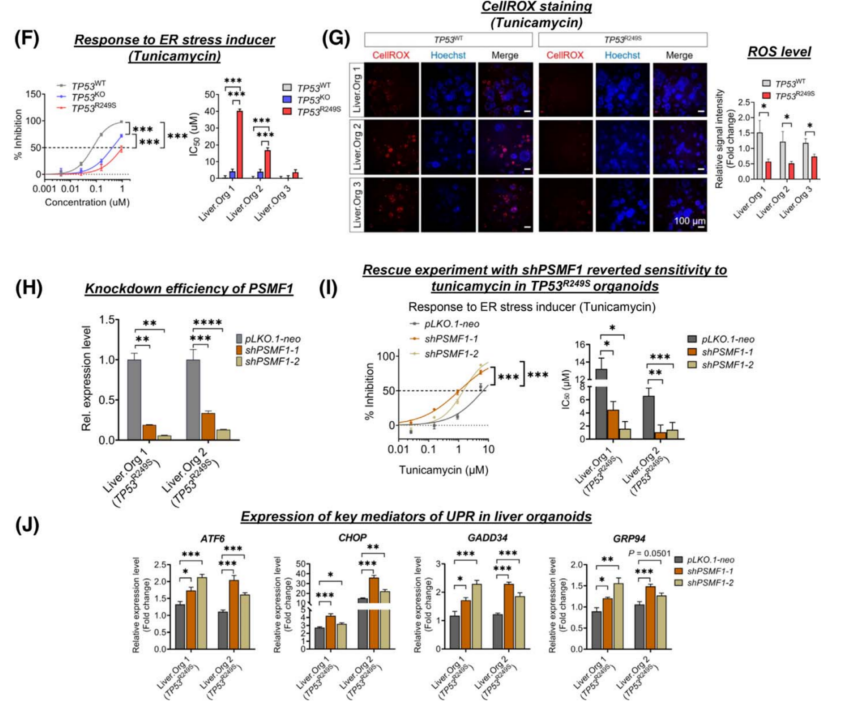
图4 TP53R249S类器官的肿瘤起始
4、通过染色质重塑靶向TP53R249S的治疗窗口
GO分析显示R249S显性靶点中“染色质重塑”显著富集(图1Giii),其中R249S显性靶点(BPTF、BRPF1和SMARCD2)在TP53R249S肝类器官中的显著上调(图5A)。硫鸟嘌呤是一种抑制DNA合成和甲基化的表观遗传药物,在体外研究硫鸟嘌呤对TP53R249S类器官的药理作用。结果显示,与WT对照相比,TP53R249S类器官对硫鸟嘌呤处理更敏感,IC50值显着增加了4.5-7倍(图5B)。
为了进一步证实硫鸟嘌呤的体内疗效,建立了肝脏类器官TP53R249S的ODX模型。一旦肿瘤体积达到约50mm3,将小鼠随机分组,连续14天腹膜内给予硫鸟嘌呤(1.5mg/kg)或载体。研究结果显示,TP53R249S ODXs对硫鸟嘌呤更敏感,与对照对照相比,治疗14天后肿瘤体积明显缩小(图5C,D)。两治疗组体重无显著差异(图5E)。在所有主要器官中也观察到正常的组织学,表明硫鸟嘌呤的副作用可以忽略不计(图5F)。总之,硫鸟嘌呤在体外和体内有针对TP53R249S引起的GOF的治疗潜力。
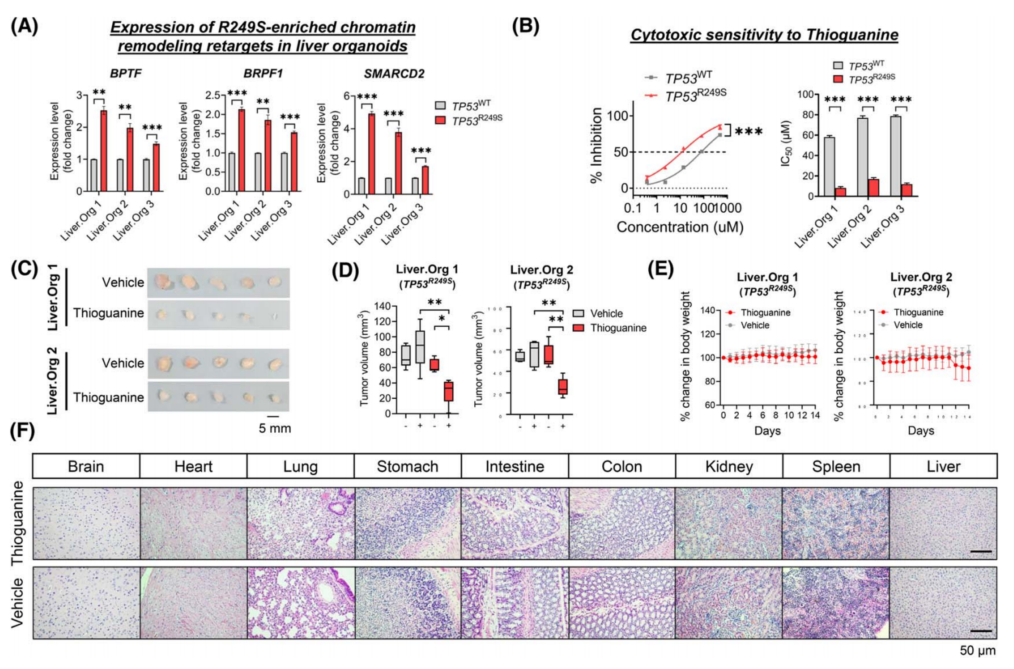
图5 靶向TP53R249S的治疗窗口期
三、研究结论
利用ChIP-seq对TP53和H3K27ac联合分析,并通过CRISPR构建TP53缺失和TP53突变的肝脏类器官,揭示了TP53 缺失导致抑癌功能的丧失和TP53的L3的获得性功能突变,促进了肝细胞癌的发生和进展;并且验证了硫鸟嘌呤有针对TP53R249S的治疗潜力。
参考文献:
TP53 R249S mutation in hepatic organoids captures the predisposing cancer risk.[J]Hepatology, 2022.