| 时间:2024-03-07 |
2023 年发表于《Gut》(IF =24.5)
一、研究背景
结直肠癌(CRC)是世界上最常见的癌症之一,其危害性高,在转移患者中 5 年生存率低 于 20%。N6-甲基腺苷(m6A)是最丰富的 RNA 修饰之一,估计每个 mRNA 分子上有 3-5 个 m6A 位点,由 Writers、Erasers 和 Readers 调节。m6A Writers 催化 m6A 的形成,包含 METTL3、 METTL14、WTAP;m6A 也会被 FTO 和 ALKBH5 等 Erasers 去除。m6AReaders,如 YTHDF1/2/3、YTHDC1/2 和 IGF2BP1/2/3 与 m6A 修饰 mRNA 的结合,决定 m6A 修饰 mRNA 的命运。m6A 调控因子如 YTHDF1、METTL3 和 ALKBH5 在癌症中已得到了深入的研究, YTHDF1 可促进肿瘤发生和癌症转移。然而,YTHDF1 在肿瘤免疫微环境(TIME)中的作用 在尚不清楚。
通过研究癌症基因组图谱(TCGA) CRC 数据集中发现 YTHDF1 的表达与干扰素γ (IFN-γ) 信号负相关。肠道特异性敲入 Ythdf1 蛋白驱动免疫抑制 TIME,促进自发结直肠癌形成。通 过 MeRIP- seq、RNA- seq 和 Ribo- seq 的综合分析,YTHDF1- m6A- p65- CXCL1 轴被确定 为 YTHDF1 诱导免疫抑制的机制,导致髓系来源抑制细胞(MDSCs)募集抑制效应细胞, 如功能性 CD8+ T 细胞。此外,在 MSS 和 MSI- H 模型中通过 CRISPR、VNPs- siRNA 靶向 YTHDF1,发现都增强了抗 PD1 的疗效,YTHDF1 作为 CRC 免疫治疗的靶点。
二、研究结果
1、YTHDF1 与结直肠癌中 IFN-γ相关基因特征降低和预后不良相关
通过使用 TCGA 数据分析 21 种已知 m6A 调节因子的拷贝数变化,提示 YTHDF1 具有 促进 CRC 的功能。为了建立抗肿瘤免疫与 m6A 调节因子之间的联系,进行 GSEA 分析 m6A 调节因子与 IFN-γ反应基因标记之间的相关性。YTHDF1 的表达与 IFN-γ相关的 18 个基因 特征显著负相关(图 1A),该特征预测了多种癌症类型的抗 PD1 反应性。来自 CRC TMA 队 列的 TMA IHC 染色显示,队列 I (p<0.001, r= - 0.248, n=206)和队列 II (p<0.0001, r= - 0.269, n=202)中,YTHDF1 蛋白的高表达与 CD8+ T 细胞的低浸润相关(图 1B)。这些数据说明 m6A Readers YTHDF1 与抗肿瘤免疫功能受损和 ICB治疗效果降低有关。
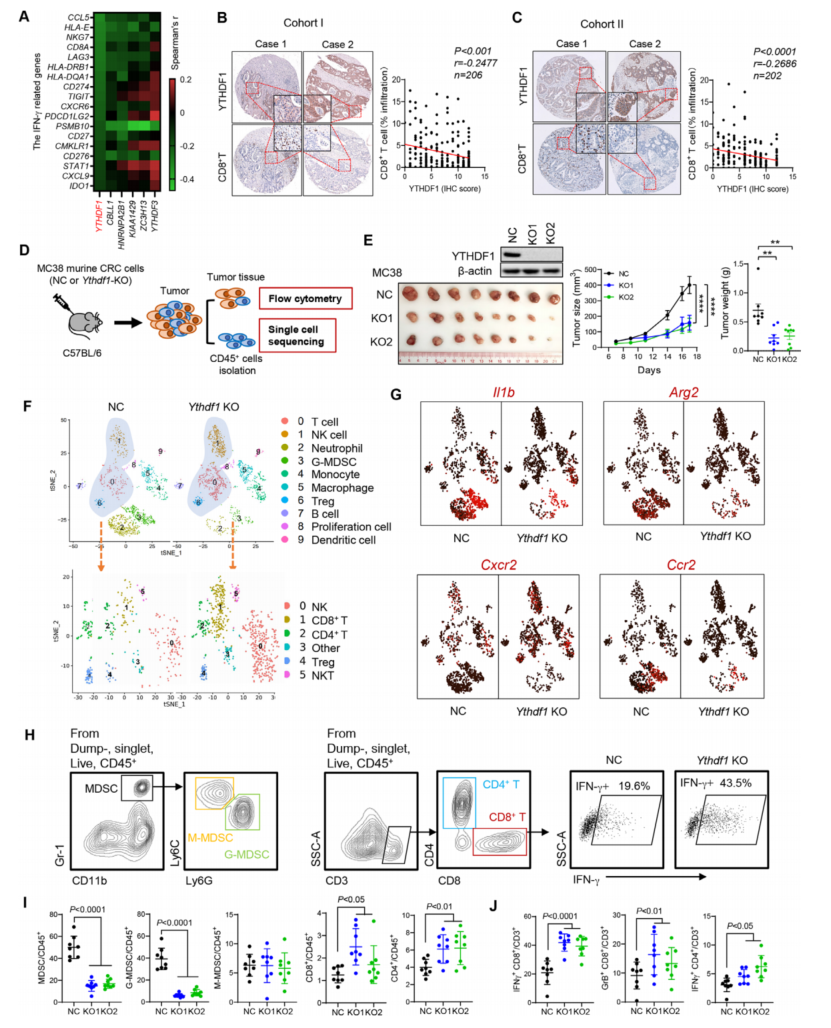
图 1 YTHDF1 与结直肠癌(CRC)患者的免疫抑制微环境有关,并通过 scRNA-seq 验证
2、单细胞转录组学表明 YTHDF1 会诱导免疫抑制
为了研究 YTHDF1 在调节抗肿瘤免疫中的作用,使用 CRISPR- Cas9 系统敲除 MC38 小 鼠 MSI- H CRC 细胞中的 YTHDF1 (YTHDF1 - KO),并将细胞注射到同基因 C57BL6 小鼠(图 1D)。与对照组(NC)相比,敲除 Ythdf1 后,肿瘤体积和重量都减少了(图 1E)。为了解 Ythdf1- KO 是否影响 TIME,从肿瘤中分离出 CD45 +免疫细胞,并进行单细胞 RNA- seq (scRNA- seq) (NC:1480 个细胞;Ythdf1- KO:1816 个细胞)。与 NC 组相比,具有 Ythdf1- KO 的 T 肿瘤 表现出粒细胞髓系抑制细胞(G- MDSCs,簇 3)和中性粒细胞的显著减少(图 1F)。相比之下,Ythdf1- KO 肿瘤中 T 细胞和 NK 细胞大量增加(图 1F)。进一步将 T 细胞和 NK 细胞重新 为 CD4 + T、CD8 + T、NKT 和 NK 细胞亚群,并发现它们在 Ythdf1- KO 肿瘤中同时增加(图 1F)。因此,推测 YTHDF1 可以通过诱导 MDSC 积累来抑制抗肿瘤免疫。检测了 MDSCs 的 功能标记物 Il1b、Arg2、Cxcr2 和 Ccr2,这些基因主要富集于 MDSC 簇(簇 3 和簇 4),特别 是来自未敲除 Ythdf1 的肿瘤(图 1G)。因此,YTHDF1 在结直肠癌中的免疫抑制功能。
3、敲除 Ythdf1 可减少髓系来源抑制细胞(MDSCs),但增加细胞毒性 T 细胞浸润
为了验证在 scRNA- seq 分析中的发现,用流式细胞术测定了 MC38 同基因小鼠肿瘤浸 润免疫细胞的组成。证实敲除 Ythdf1 显著抑制肿瘤的重量和体积(图 1C),流式细胞术显示 敲除 Ythdf1 减少了 MDSCs,但增加了肿瘤中的 CD8 + T 和 CD4 + T 细胞(图 1H,I)。在 MDSCs 中,G- MDSCs 是主要的亚群,敲除 Ythdf1 导致 G- MDSCs 显著减少(图 1I)。与 MDSCs 的 免疫抑制功能一致,并观察到 Ythdf1- KO 组功能 T 细胞显著增加,包括 IFN-γ+ CD8+ T 细 胞、颗粒酶 B+ CD8+ T 细胞和 IFN-γ+ CD4+ T 细胞(图 1H,J)。
接下来,用 Ythdf1- KO 在 CT26 (MSS- CRC)中进行实验,验证 Ythdf1 在调节抗肿瘤免 疫中的作用。和预期结果一致,Ythdf1- KO 导致 CT26 同基因小鼠肿瘤体积和重量减小(图 2A,B),同时功能 T 细胞减少和 MDSCs 积累(图 2C,D)。免疫荧光染色证实,Ythdf1 基因 敲除后,MC38 和 CT26 同基因肿瘤中 MDSCs 的浸润减少(图 2E)。总的来说,结直肠癌细 胞中 Ythdf1 的缺失减少了 MDSCs,增加了功能性 T 细胞的浸润。
为研究 Ythdf1- KO 中肿瘤的减弱是否依赖于 CD8 + T 细胞。在 MC38 同基因模型中用抗 CD8 抗体去除 CD8 + T 细胞。CD8 + T 细胞的消耗恢复了 Ythdf1- KO 肿瘤的生长(图 2F,G),表明 Ythdf1- KO 的肿瘤抑制功能至少部分依赖于 CD8 + T 细胞。这在 CT26 同基因小鼠中得 到证实,表明加入抗 CD8 抗体后可以恢复 Ythdf1- KO 组中被抑制的肿瘤生长(图 2H,I)。Ythdf1 基因敲除通过诱导 CD8 + T 细胞依赖性抗肿瘤免疫抑制结直肠癌的生长。
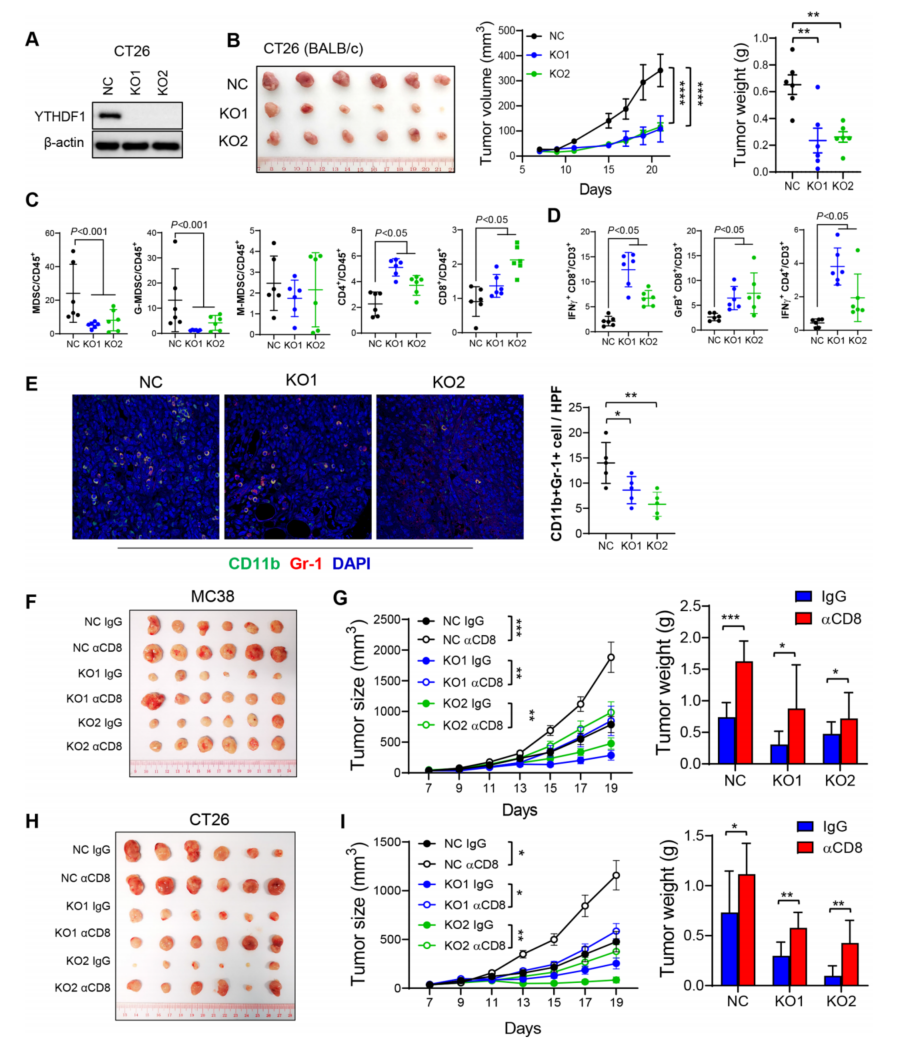
图 2 敲除 Ythdf1 可通过减少髓源性抑制细胞(MDSC)和增加功能性 T 细胞来诱导抗肿瘤免 疫,这一效应可被 CD8 + T 细胞消耗逆转
4、肠道特异性 Ythdf1 敲入促进小鼠结直肠肿瘤的发生,抑制抗肿瘤免疫
为了验证 YTHDF1 在自发性结直肠肿瘤发生中的作用,制造了肠道特异性的 YTHDF1 敲入小鼠(Ythdf1 loxp/loxpCDX2- cre),并通过 AOM/DSS 治疗在这些小鼠中诱发 CRC(图 3A)。研究发现,在 AOM/DSS 模型中,Ythdf1 过表达导致结肠肿瘤数量和大小增加(图 3C)。流式 细胞术显示,与野生型小鼠相比,Ythdf1 敲入小鼠结肠肿瘤中 MDSC 浸润增加,NK、CD4 + T 和 CD8 + T 细胞减少(图 3D)。此外,通过颗粒酶 B、INF-γ和 TNF-α的表达,Ythdf1 表达 降低了功能性 T 细胞的比例(图 3E)。
接下来,通过建立 ApcMin/+Ythdf1 loxp/ loxpCDX2-cre 小鼠,在 ApcMin/+驱动的自发性结直肠 癌中中验证这些结果(图 3B)。与此一致的是,肠道特异性敲入 Ythdf1 的 ApcMin/+小鼠的结肠 肿瘤明显大于野生型小鼠(图 3C)。分析在肿瘤浸润免疫细胞中,ApcMin/+敲除 Ythdf1 的肿瘤 中 NK、CD4 + T 和 CD8 + T 细胞的浸润显著减少,同时 MDSCs 的诱导(图 3F)。此外,Ythdf1 敲除蛋白降低了 ApcMin/+小鼠的颗粒酶 B+、INF-γ+或 TNF-α+ T 细胞(图 3G)。总之,这些 结果说明 YTHDF1 培养促进自发性 CRC的免疫抑制微环境。
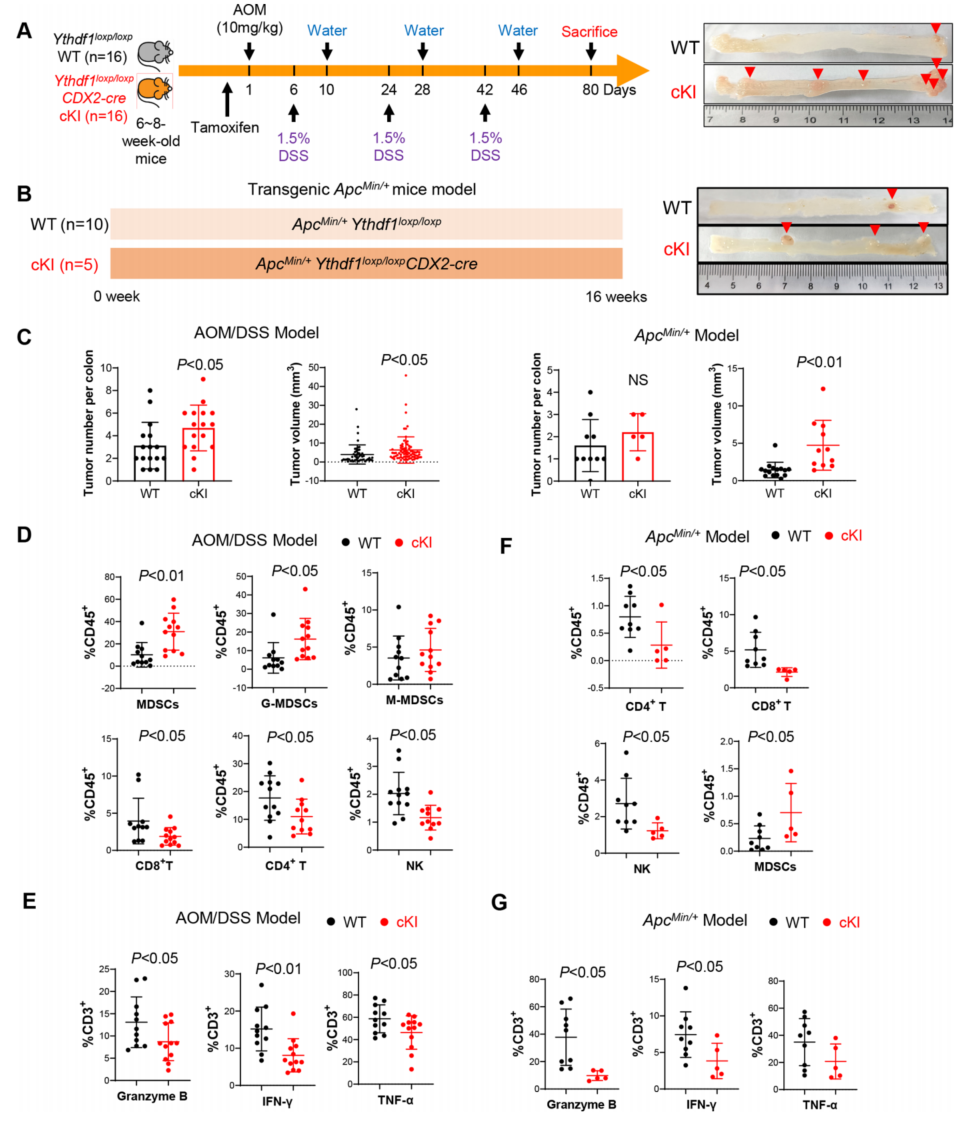
图 3 肠道特异性敲入 Ythdf1 促进小鼠结直肠肿瘤发生并抑制抗肿瘤免疫
5、通过 VNP-siYTHDF1 靶向 YTHDF1 增强 CD34 +人源化小鼠的抗肿瘤免疫
为了证实 YTHDF1 在调节人抗肿瘤免疫应答中的作用,建立了 CD34+人源化小鼠模型 (图 4A)。为了在体内靶向 YTHDF1,开发了 VNPs19 来携带针对 YTHDF1 的 siRNA。在肿 瘤达到 50-100 mm3后,携带人结直肠癌 HCT116 异种移植物的人源化 NSG 小鼠接受 VNP- siNC 或- siYTHDF1 治疗(图 4B)。与 VNP- siNC 相比,VNP- siYTHDF1 显著抑制肿瘤体积 和重量(图 4B、C);还进行了流式细胞术分析 TIME(图 4D)。VNP-siYTHDF1 降低了 MDSC 的浸润,但增加了 CD4 + T 细胞、CD8 + T 细胞和 NK 细胞的积累(图 4E)。
此外,在 VNP- siYTHDF1 组的肿瘤中发现了更多的 IFN-γ+、TNF-α+和颗粒酶 B + 、CD8 + T 细胞(图 4E)。并通过测定血清肝脏指标(丙氨酸转氨酶和天冬氨酸转氨酶)和肾功能指 标(肌酐和血尿素氮)来确定 VNP- siYTHDF1 的安全性。用 VNP- siNC 或 VNP- siYTHDF1 治疗的小鼠未出现肝肾功能指标异常,表明 VNP 治疗耐受性良好。因此,利用 VNP- siYTHDF1 靶向 YTHDF1 是增强人源化小鼠抗肿瘤免疫的一种安全有效的手段。
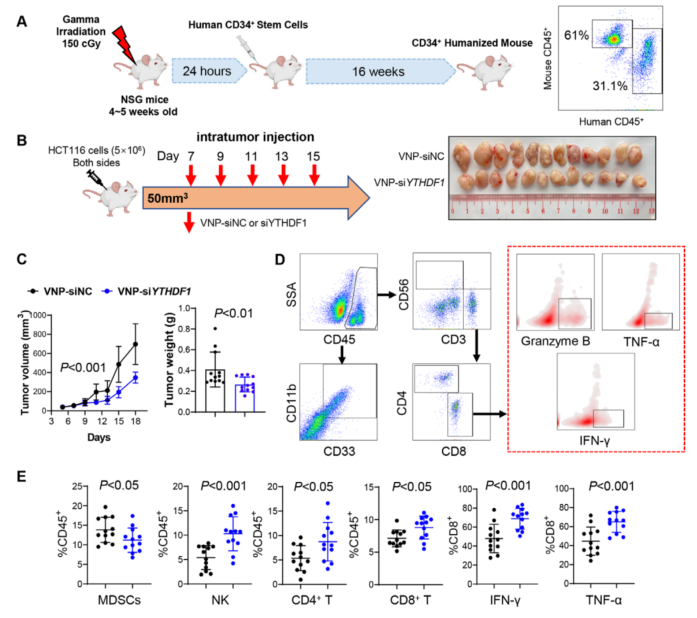
图 4 VNP- siYTHDF1 增强了 CD34+人源化小鼠的抗肿瘤免疫
6、YTHDF1 促进 p65 翻译激活 TNF/NF-κB 信号传导
为了确定 YTHDF1 引发免疫抑制的分子机制,在敲除或不敲除 YTHDF1 的 CRC 细胞中进行了 RNA-seq 和 Ribo-seq。通过 RNA-seq 分析,MC38- NC 和 MC38- ythdf1-KO 细胞之间的差异表达基因在 TNF/NF-κB 信号通路中富集。在另一种 CRC 细胞系 CT26 中获得 了一致的结果。qPCR 证实 Ythdf1- KO 降低了 TNF/NF-κB 靶点的 mRNA 表达。此外,Ribo- seq 数据显示,YTHDF1 的缺失与 TNF 信号的失活显著相关;YTHDF1 敲除降低了参与 TNF 信号传导的基因的核糖体保护的片段丰度(图 5A)。因此,YTHDF1 可以通过促进蛋白翻 译调节 TNF/NF-κB 信号传导。
由于 YTHDF1 具有 m6A Reader 的功能,接下来进行了 MeRIP- seq 来确定 m6A 修饰的 转录本。通过筛选参与 TNF 信号传导的 mRNA 中的 m6A 峰,确定了两个靠近 p65 mRNA 停止密码子的 m6A 位点(图 5B),并通过 MeRIP- qPCR 进行了验证(图 5C)。并通过 RNA 免 疫沉淀(RIP)测序和抗 YTHDF1 抗体的 RIP- qPCR 鉴定了 YTHDF1 和 p65 mRNA 之间的直 接相互作用(图 5D)。因此,p65mRNA 是 YTHDF1 的直接靶点。敲除 Ythdf1 可降低 CT26 和 MC38 细胞中 p65 蛋白的表达,尤其是核 p65 的表达,而不影响 NF-κB 通路的其他调节 因子如 IKKα和 i-κBα的表达(图 5E)。
在人类结直肠癌细胞中获得了一致的结果,野生型 YTHDF1 过表达,而非功能失调突 变体,p65 蛋白表达升高;相反,YTHDF1 敲低会减弱人类结直肠癌细胞中的 p65 蛋白(图 5F)。使用抗 YTHDF1 抗体的 RIP- qPCR 也证实了人 CRC 细胞中 YTHDF1 与 p65 mRNA 之 间的直接相互作用(图 5G)。接下来为在体内验证 YTHDF1 和 p65 的关联。在敲除 Ythdf1 基 因的小鼠中,结肠肿瘤中的 p65 和 phospho- p65 蛋白均升高(图 5H)。总之,YTHDF1 促进 p65 蛋白的表达,激活 TNF/NF-κB 信号在体外和体内。
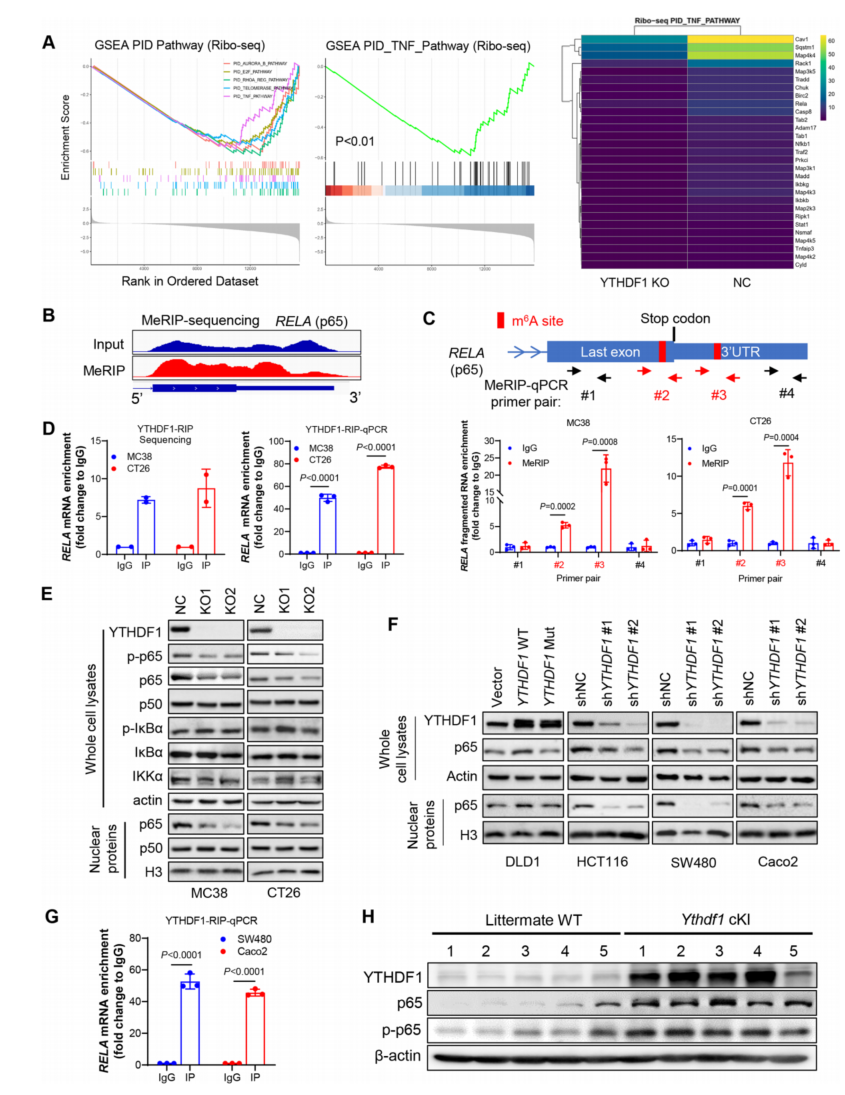
图 5 YTHDF1 通过促进 p65 mRNA 翻译促进 CRC 中 TNF/NF- kB 信号传导
7、YTHDF1 通过 p65-CXCL1 轴促进髓系来源抑制细胞(MDSCs)迁移
为进一步研究 YTHDF1 诱导的 p65 与其免疫抑制之间的联系,在 CRC 细胞、肿瘤裂解物和同基因肿瘤小鼠血清的条件培养基中检测了 23 种不同的小鼠细胞因子的多重免疫分析。在这些细胞因子中,Ythdf1- KO 持续降低 CXCL1(图 6A),并且通过 ELISA 检测证实了 CXCL1 的降低(图 6B)。据报道,CXCL1 是 NF-κB 信号传导的转录靶点,它通过与其受体 CXCR2 的相互作用促进 MDSC 趋化。鉴于 Ythdf1- KO 在 CRC TIME 减少 MDSC 浸润,我们想知道 Ythdf1 是否调节 MDSC 迁移。因此,进行了 MDSC 体外迁移实验。发现野生型 CRC 细胞的条件培养基增强了 MDSC 的迁移,而这种迁移被 Ythdf1 的敲除所破坏(图 6C)。
通过 CXCR2 抑制剂 SB265610 阻断 CXCL1- CXCR2 相互作用,消除了对照组和 Ythdf1- KO 培养上清在介导 MDSC 迁移方面的差异(图 6C)。因此,YTHDF1 通过 CXCL1/CXCR2 轴促进 MDSC 迁移。敲除 Ythdf1 显著抑制了小鼠(图 6D)和人 CRC 细胞系(在线补充图 S7A) 中 Cxcl1 mRNA 的水平。相反,野生型 YTHDF1 的过表达,会升高人类 CRC 细胞中 CXCL1 的转录和蛋白水平。NF-κB 激活剂,如 TNF-α和 IL- 1β,可诱导 CXCL1 表达。因此,用 TNF-α处理 MC38 细胞,TNF-α刺激 Cxcl1 mRNA 和蛋白分泌,这一作用被 Ythdf1 的缺失所抵消。为了证实 YTHDF1 和 CXCL1 在人类 CRC 中的联系,检测了 TCGA CRC 队列中 YTHDF1 和 CXCL1 表达之间的关系,得到了一致的结果。上述结果表明,YTHDF1- p65- CXCL1/ CXCR2 轴介导 CRC 中 MDSC 的迁移。
接下来,研究了 YTHDF1 是否影响 MDSC 功能。从 MC38 同基因肿瘤中分离 CD11b+Gr-1 + MDSCs,然后与 T 细胞体外共培养(图 6E)。从对照肿瘤中分离的 MDSCs 抑制 T 细胞增殖;与来自对照组的 MDSCs 相比,来自 Ythdf1- KO 肿瘤的 MDSCs 对 CD8 + T 细胞 和 CD4 + T 细胞的增殖抑制活性明显降低(图 6F,G)。这些数据验证了 MDSCs 对关键效应细胞(包括 CD8 + T 细胞和 CD4 + T 细胞)的免疫抑制功能,也说明表达 YTHDF1 的 CRC 会招募功能性 MDSCs。
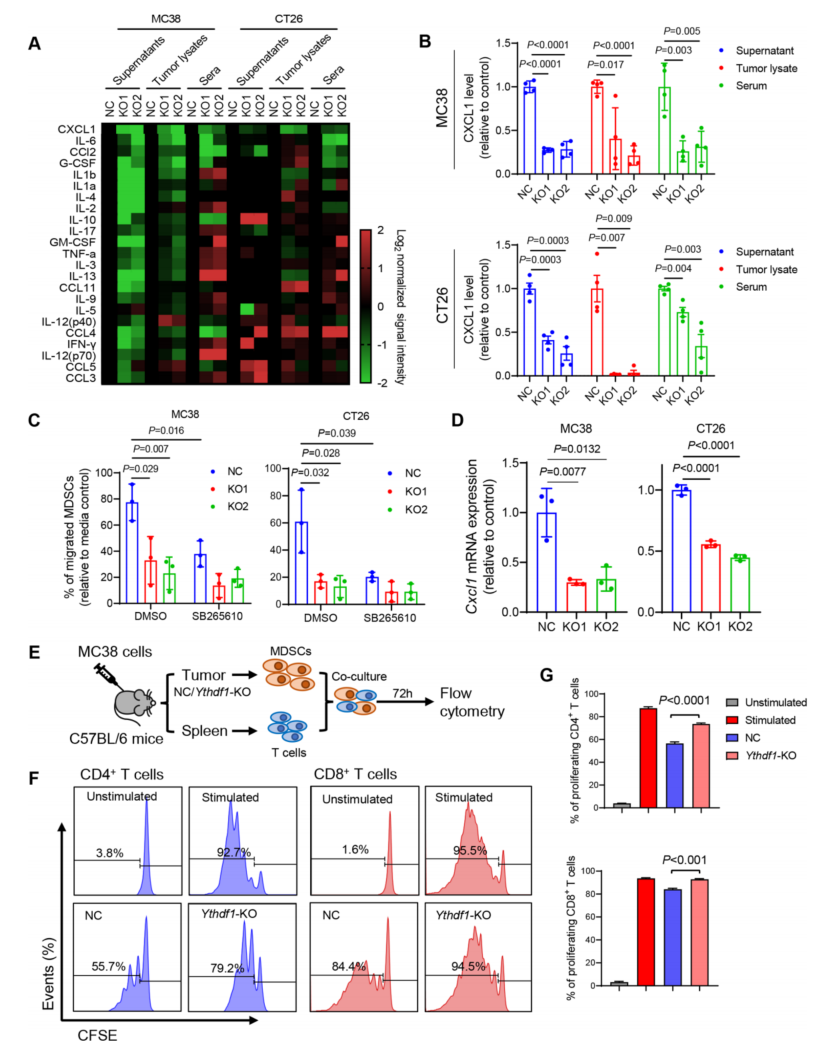
图 6 Ythdf1 的缺失通过减少 CXCL1 分泌来促进髓源性抑制细胞(MDSCs)的减少
8、YTHDF1 是 CRC 免疫治疗的潜在治疗靶点
已有研究报道 MDSCs 浸润减少与各种癌症类型的免疫治疗效果增强相关,本研究试图测试靶向 YTHDF1 是否能增强 CRC 的抗 PD1 治疗。正如预期一样,敲除 Ythdf1 增强了 MC38 (MSI- H)同基因肿瘤中抗 PD1 的功效,延长了荷瘤小鼠的生存期(图 7A)。进一步利用 VNPs 系统将特异性 Ythdf1- siRNA 传递到肿瘤中。当 MC38 同基因肿瘤达到 50~100 mm3时,用 VNP- siYthdf1(或 VNP- siNC)和抗 PD1(或 IgG)治疗小鼠。与 VNP- siNC 相比,VNP- siYthdf1 显著抑制 MC38 肿瘤生长(图 7B,C)。其中,VNP- siYthdf1 与 anti- PD1 联合使用对肿瘤生长的抑制作用最强(图 7B,C)。
基于同基因 CT26 (MSS CRC)肿瘤模型,进一步研究了靶向 YTHDF1 是否可以克服 MSS CRC 的抗 PD1 耐药性。因此,将敲除 Ythdf1 的 CT26 细胞注射到同基因小鼠体内,并用抗 PD1 处理。发现敲除 Ythdf1 显著增强了 CT26 同基因肿瘤的抗 PD1 治疗效果,否则这些肿瘤对 ICB 治疗无反应(图 7D, E)。
流式细胞术分析进一步显示,在 CT26 和 MC38 同基因模型中,Ythdf1 沉默和抗 PD1 联合使用显著增加了肿瘤浸润的功能性细胞,包括 IFN-γ+ CD8 + T 细胞和颗粒酶 B+、CD8 + T 细胞(图 7F,G)。此外,联合治疗显著减少了 MDSCs 的积累,而诱导 CD4 + T 细胞和 CD8 + T 细胞(图 7G)。因此,靶向 YTHDF1 不仅可以增强 ICB 在 MSI- H 型 CRC 中的治疗效果, 还可以通过抑制募集来克服 MSS 型 CRC 中的 ICB 耐药性。
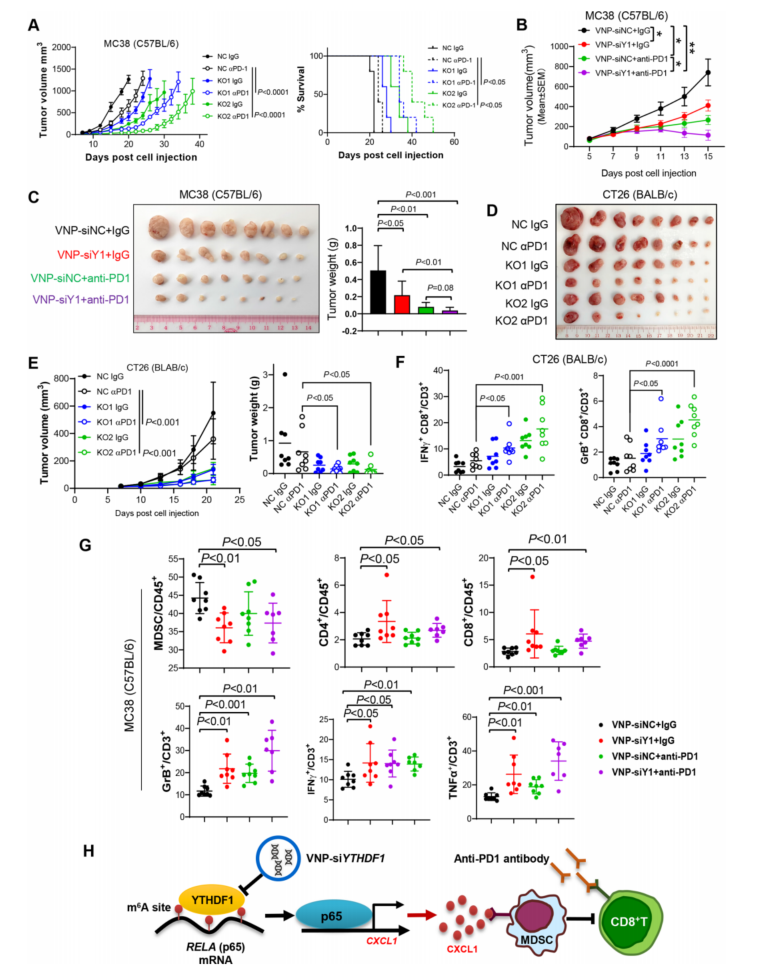
图 7 T 靶向 YTHDF1 可增强结直肠癌(CRC)的抗 PD1治疗
三、研究结论
YTHDF1 促进 p65 翻译激活 TNF/NF-κB 信号传导,并通过 p65-CXCL1 轴促进髓系来源抑制细胞(MDSCs)迁移,靶向 YTHDF1 可增强抗 PD1 的功效,YTHDF1 作为 CRC 免疫治疗的治疗靶点。
参考文献:
Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti- PD- 1 efficacy in colorectal cancer.[J]Gut, 2023.