| 时间:2024-03-25 |
2021年发表于《Aging Cell》(IF =11)
一、研究背景
细胞衰老会引起细胞状态和表型变化,与许多生物学过程相关,例如肿瘤抑制、胚胎发生、组织修复、宿主免疫、衰老和与年龄相关的疾病。表观基因组是连接基因型和表型的桥梁,在衰老过程中,基因组的甲基化水平会发生变化,我们称之为DNA甲基化时钟;组蛋白修饰的变化也会反映染色质结构的不同状态。DNA甲基化改变和组蛋白修饰改变染色质结构,影响基因表达谱,从而决定细胞命运。染色质可及性在调节基因表达中发挥很重要的作用。本研究通过ATAC-seq,构建了人脐静脉内皮细胞(HUVECs)衰老期间染色质可及性图谱,并结合基因表达谱,研究人类脐静脉内皮细胞(HUVEC)衰老中的相关机制。
二、研究结果
1、人脐静脉内皮细胞(HUVECs)复制性衰老的转录图谱
为了研究衰老机制,使用原代HUVEC在体外构建了一个复制性衰老系统,并使用经典的衰老标记SA-β-gal和Ki-67来评估复制系统的可靠性。随着HUVEC培养时间的推移,它们的信号分别逐渐增加,然后下降(图1a-c)。结果说明,建立的HUVEC衰老系统是稳定可靠的。 接着使用RNA-seq,研究了HUVEC衰老模型中基因表达的动态变化。首先,在衰老过程中,CDKN1A、CDKN2A和TGFBI的表达逐渐增加,而LMNB1和MKI67的表达逐渐降低(图1e),与以往研究一致。GO富集分析显示,上调的基因主要参与黏附信号通路和细胞外基质受体通路,这两个通路与粘附斑块形成和细胞迁移等衰老表型密切相关 ;参与DNA复制和细胞周期相关途径的基因下调,结果与衰老过程中细胞周期停滞相符合。
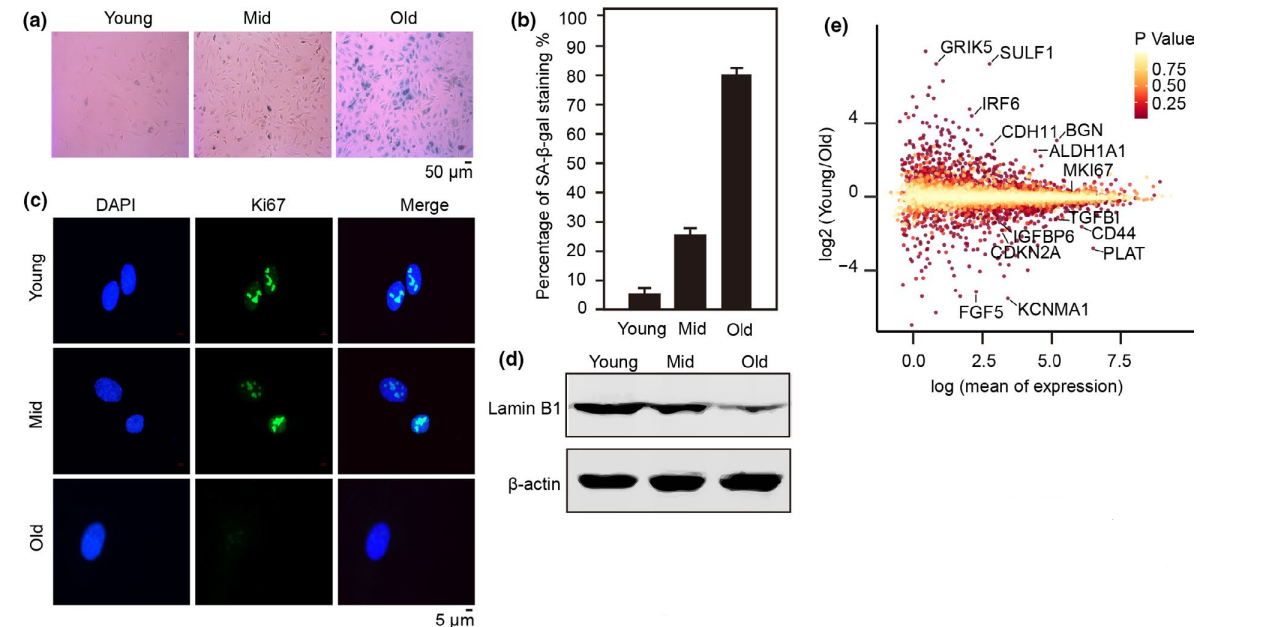
图1 复制性衰老的基因表达和染色质可及性的全基因组图谱
2、衰老过程中染色质可及性图谱
在衰老过程中,IGFBP6、KLF2 和TGFB1 的表达上调,基因的启动子可及性显著增加,而显著下调的基因IGF2、FOXM1 和MYBL2 的染色质可达性降低(图1f)。这些结果表明,染色质可及性参与了衰老过程中基因表达的变化,特别是在可能引发衰老的关键基因中。染色质可及性区域大多位于基因间区、内含子区和外显子区,在这些区域增强子的数量比例最高(图1g)。例如,ATAC-seq信号在RNF11周围的激活启动子和强增强子中富集(图1h)。总的来说,来自HUVEC细胞的ATAC-seq峰最普遍富集于增强子中。
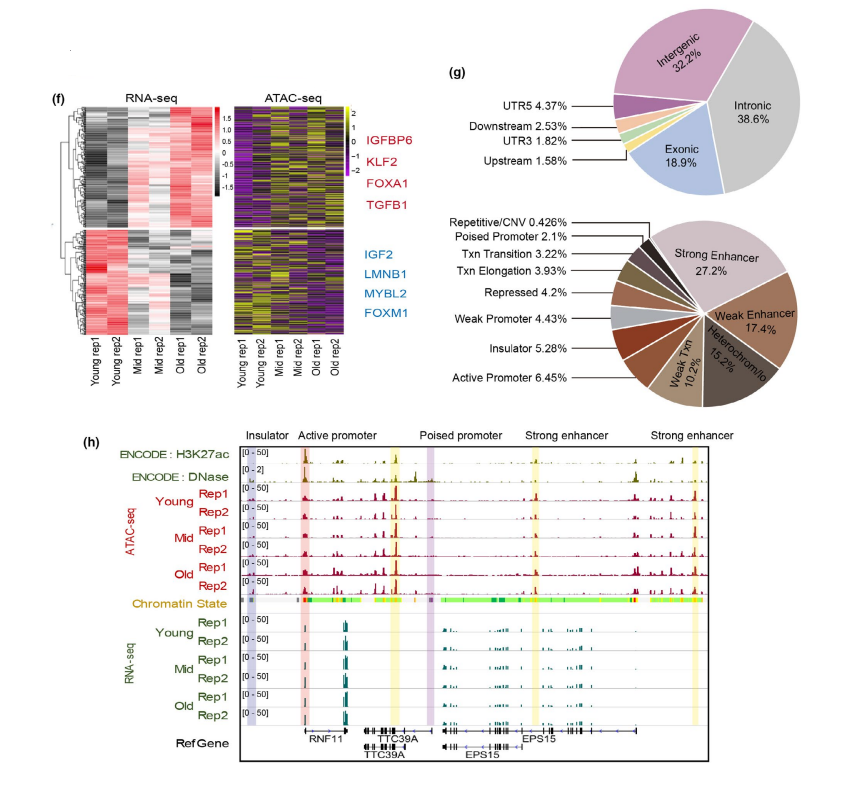
图1 复制性衰老的基因表达和染色质可及性的全基因组图谱
3、衰老过程中染色质可及性的动态变化
通过比较不同衰老阶段的全基因组ATAC-seq信号,可以研究具有染色质可及性变化的衰老特异性区域。ATAC-seq峰在不同的衰老阶段是动态的,表明在衰老过程中染色质可及性重新排列。这些峰主要位于增强子中,表明增强子-基因调控网络随着衰老的进行而重构。接下来,发现衰老过程中有1038个可及性增加区域(IARs)和964个可及性减少区域(DARs)(图2a)。 增强子元件在IARs和DARs中富集(图2b),可及性变化区域远离TSS(图2c)。大多数IARs(97.4%)和DARs(94.5%)位于距离TSS 2kb的位置(图2d),表明它们是潜在的增强因子。
综上所述,这些结果表明,在衰老过程中染色质可及性谱被重排,IARs主要分布在增强子中。
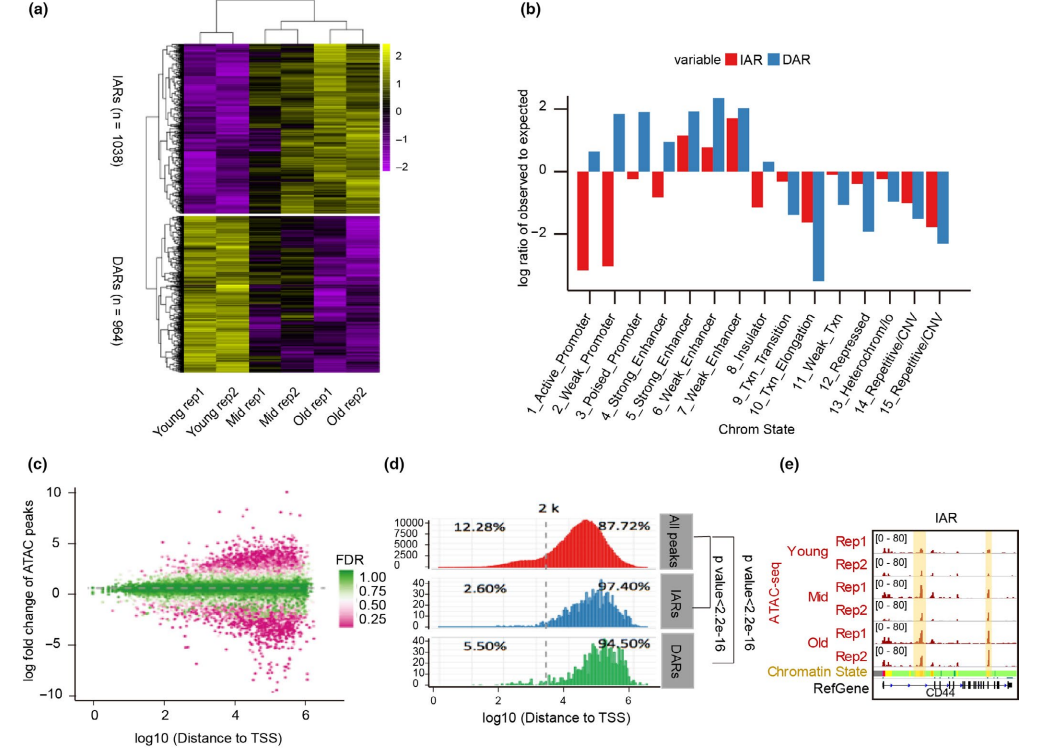
图2 衰老过程中染色质可及性的动态变化
4、衰老过程中基因调控网络的重构
为了研究IARs和DARs在衰老命运决定中的作用,分析了在IARs和DARs附近发现的基因的表达情况。IARs附近的基因上调,DARs附近的基因下调(图3a,b)。这一结果表明IARs和DARs可能正向调控邻近基因的表达,与以往的研究一致。IARs附近基因的信号通路参与TGF-β通路(图3c),DARs附近基因的主要功能是在蛋白多糖和软骨素代谢过程中。结果表明,IARs可能通过相关基因参与的衰老相关信号通路来调控衰老命运。
此外,使用RT-PCR和ChIP- qPCR方法验证了相邻基因的表达水平和IARs增强子活性。发现CD44等基因mRNA水平升高(图3f)。相应的,在衰老过程中H3K27ac和H3K4me1的ChIP-qPCR信号,在CD44等基因附近的IARs和ATAC-seq峰处逐渐增加(图3g、h)。这些发现表明,IARs作为表观遗传增强子,可能调节附近基因的表达。综上所述,染色质可及性的重建影响衰老特异性IARs和DARs的增强子活性,这可能进一步调节邻近衰老基因的表达。
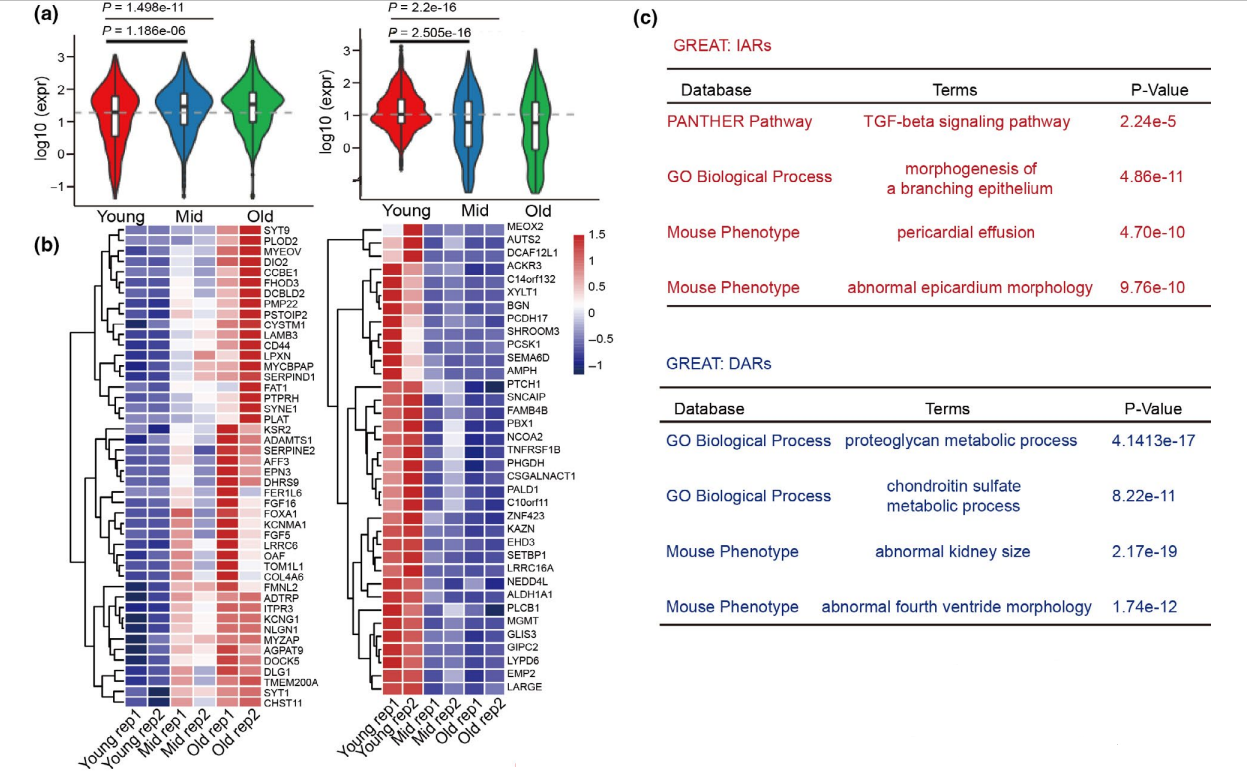
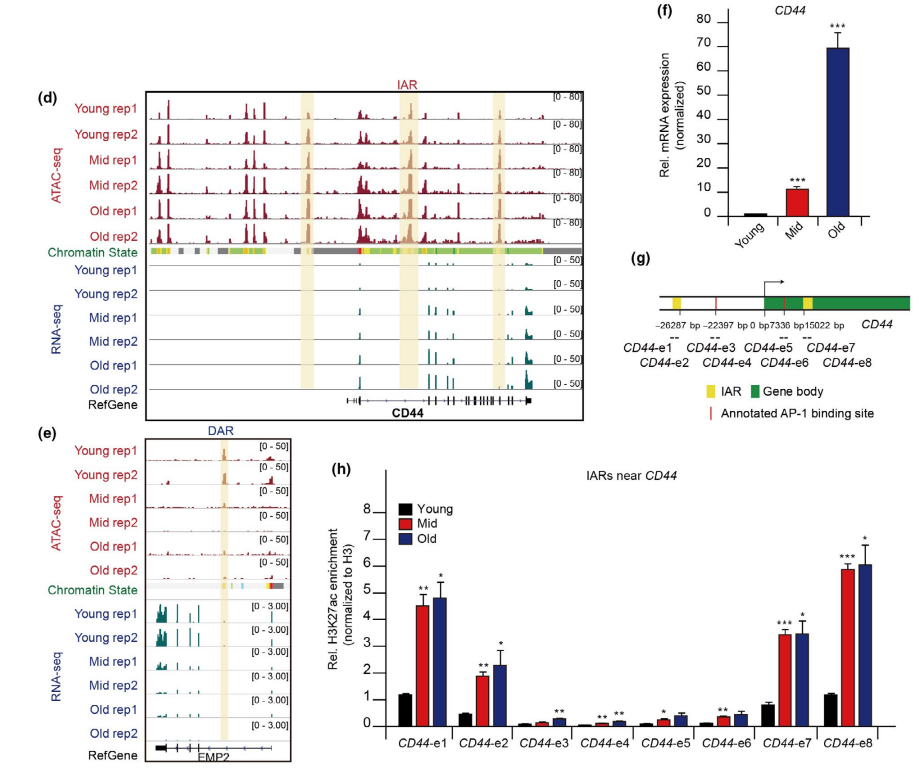
图3 衰老过程中基因调控网络重构
5、DNA甲基化可能有助于染色质可及性重构
在衰老过程中,染色质可及性发生规律重排的过程与DNA甲基化重建模式非常相似。为研究DNA甲基化和染色质可及性之间的关系。首先比较了HUVEC衰老过程中DNA甲基化(5-甲基胞嘧啶)的数据(Franzen et al., 2017)与本研究的ATAC-seq数据,发现ATAC-seq信号与衰老过程中DNA甲基化水平呈负相关(图4a),并且在ATAC-seq峰值区域DNA甲基化较低(图4b,c);这些发现与之前的研究一致。
通过分析IARs和DARs的DNA甲基化变化,发现在衰老过程中,IARs的DNA甲基化水平逐渐下降,DARs的DNA甲基化水平逐渐上升(图4d)。结果表明,DNA甲基化模式的重建参与了染色质可及性重塑,降低DNA甲基化可能有助于染色质在调控元件上的可及性。
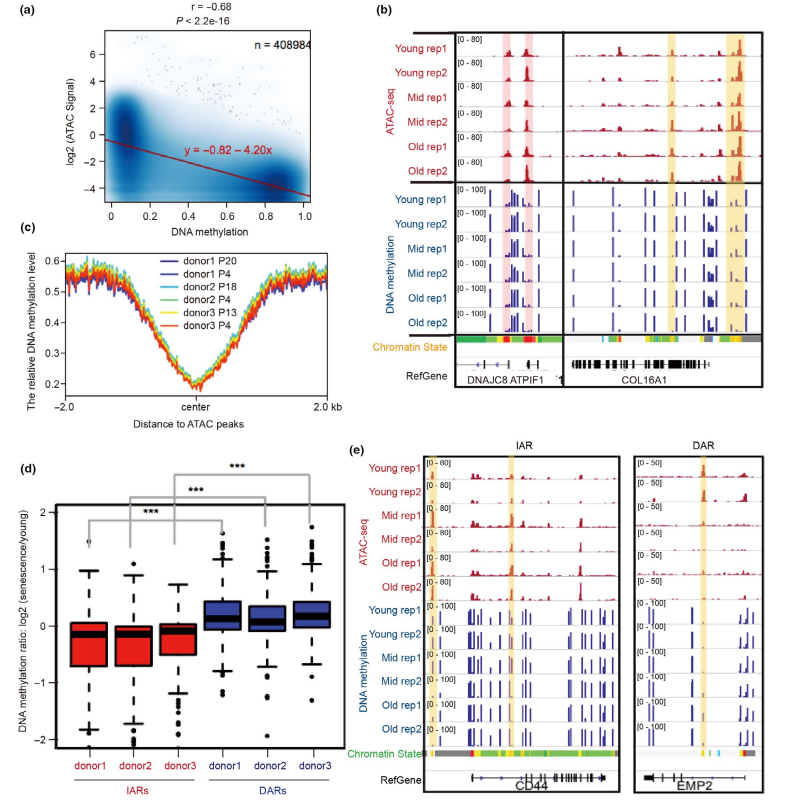
图4 DNA甲基化可能有助于染色质可及性重构
6、AP-1通过调节IARs中的染色质可及性促进衰老
为了获得可能驱动染色质可及性重构的关键因素,使用HOMER和MEME两种算法对IARs和DARs中的转录因子进行motif富集分析,发现AP-1家族在IARs中富集程度最高(图5a)。AP-1家族成员中,ATF3 motif最为显著。结合IARs可能调控的经典衰老信号通路(图3c), AP-1家族可能通过重塑IARs的染色质可及性来驱动HUVEC衰老。此外,AP-1基序的甲基化水平在开放染色质区域低于封闭染色质区域(图5b),这表明AP-1中的DNA甲基化水平可能影响IARs的染色质可及性。
在IARs中富集的AP-1转录因子中排名最高的是ATF3,ATF3足迹随着衰老过程逐渐出现(图5c),说明ATF3可以调节IARs的可达性。因此,在HUVECs中进行了ATF3敲低和过表达实验,发现ATF3缺失后,衰老标志p16下调(图5d,e),敲除ATF3后SA-β-gal信号降低。相反,当ATF3过表达时,p16表达上调,SA-β-gal信号增强(图5f-i),证明ATF3确实能促进衰老。
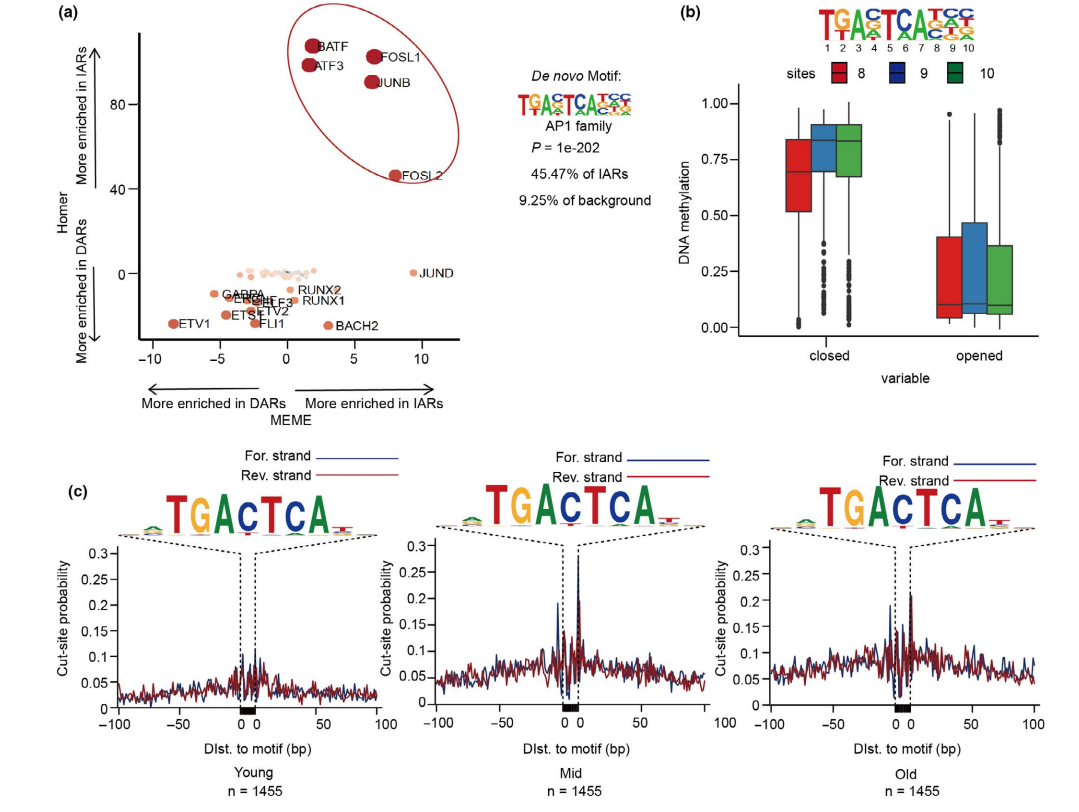
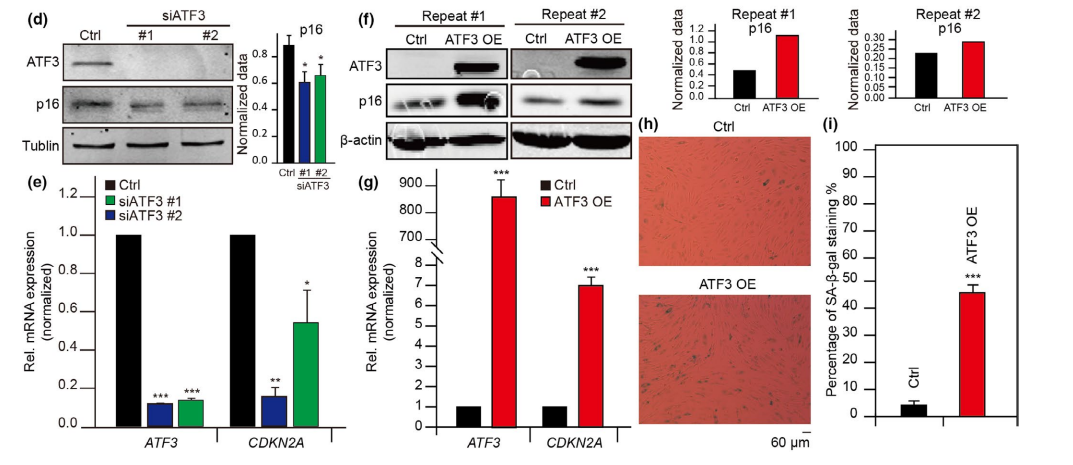
图5 AP-1通过调节IARs的可及性促进衰老
此外,在HUVEC衰老过程中,IARs中ATF3的富集增加。ATF3过表达后,IARs上ATF3结合增强(图6b), IARs周围基因表达增加(图6a)。同时,IARs的H3K27ac、H3K4me1、ATAC-seq信号也得到改善(图6c、d)。这些结果表明,ATF3与IARs结合,打开染色质,进一步激活邻近基因的表达。综上所述,AP-1家族,特别是ATF3参与了一个衰老程序的建立,该程序调节IARs中的可及性,从而进一步重建了衰老相关基因的表达谱(图6e)。
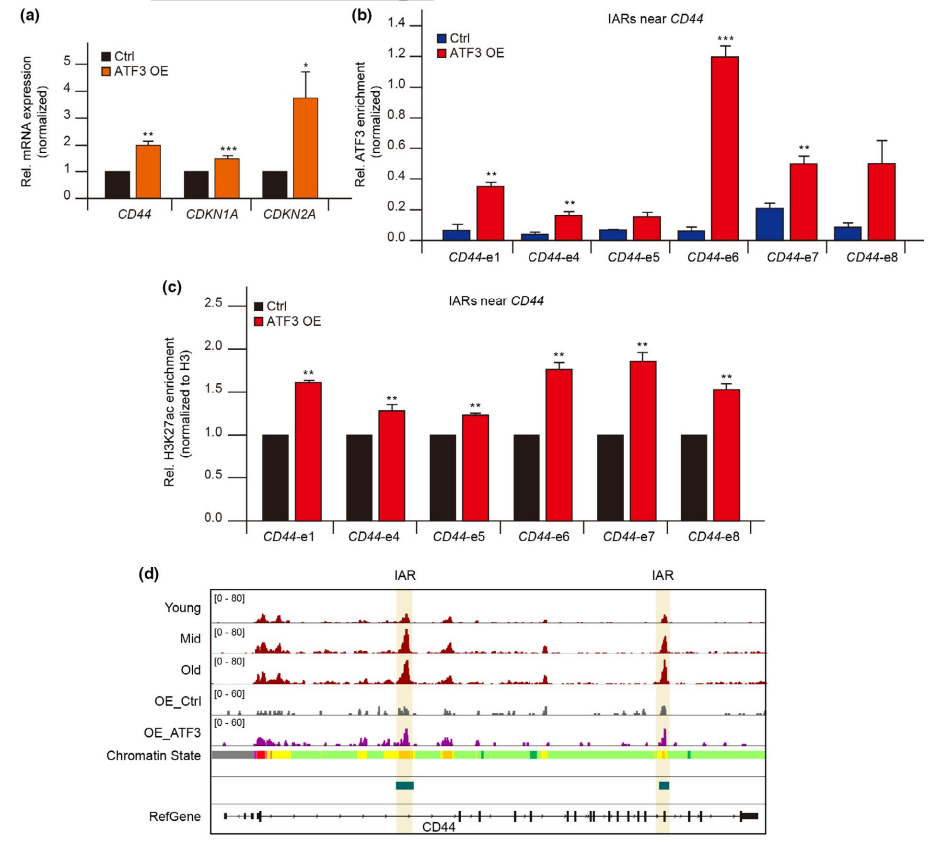
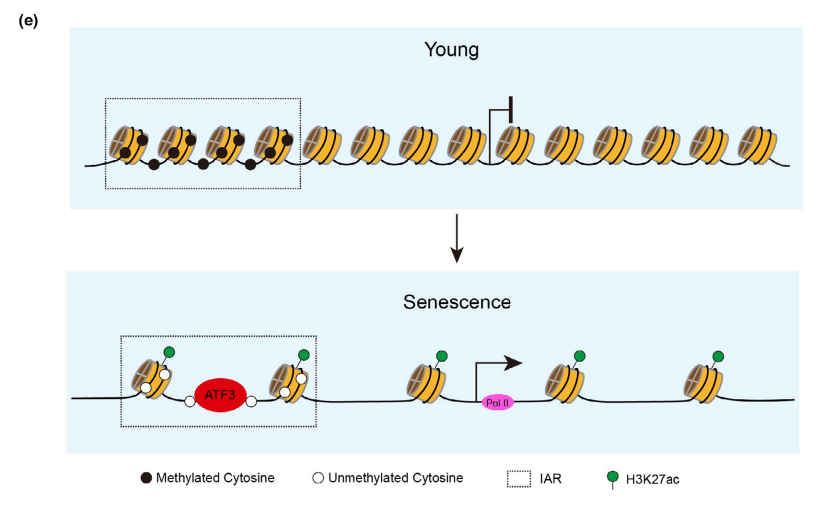
图6 ATF3负责IARs的可及性重构
三、研究结论
通过ATAC-seq,构建了人脐静脉内皮细胞(HUVECs)衰老期间染色质可及性图谱,并结合基因表达谱,AP-1转录因子调控IARs的开放,AP-1成员ATF3通过重塑染色质可及性促进细胞衰老。
参考文献:
ATF3 drives senescence by reconstructing accessible chromatin profiles.[J]Aging Cell, 2021.