| 时间:2023-12-18 |
2021年发表于《Cell Death and Disease》(IF =9.6)
一、研究背景
肝细胞癌(HCC)是最常见的癌症之一,我国的HCC新发病例和相关死亡人数占全球总数的一半以上。在真核生物中,组蛋白是核小体的最基本成分,是染色质的结构和功能的基本单位。组蛋白变体通过在染色质特定位置或特定生物过程中取代常规组蛋白,来调节染色质结构和相关生物过程。随着蛋白质组学的发展,发现组蛋白变体在基因转录调控中发挥着重要作用,在不同肿瘤中也起着至关重要的作用。
组蛋白或组蛋白变体对肿瘤的发展至关重要,因此本研究旨在探讨HCC与组蛋白或组蛋白变体相关性以及潜在作用机制。
二、研究结果
1、RNA-seq结果和目的基因鉴定
通过分析23对原始数据(GEO数据库中获得,不是转录本)和3对HCC细胞和癌旁组织的基因数据,发现H2A.Z,在HCC组织中显著表达(图1A)。肝癌组织中H2A.Z水平显著高于正常肝组织(图1B)。进一步测定30对HCC组织和非癌组织,以及96例冰冻癌症组织中H2A.Z水平,发现原发性HCC组织中H2A.Z水平明显高于其配对的相邻正常组织(图1C, E)。与正常人肝细胞系相比,HCC细胞系中的H2A.Z水平也有所增加(图1D, F)。
采用Cox风险模型对肝癌患者的临床资料及预后进行分析,HCC中高H2A.Z水平可以显著预测HCC患者预后不良(图1G)。此外,基于TCGA数据的在线分析显示H2A.Z水平与HCC患者的总生存期呈负相关(图1H)。
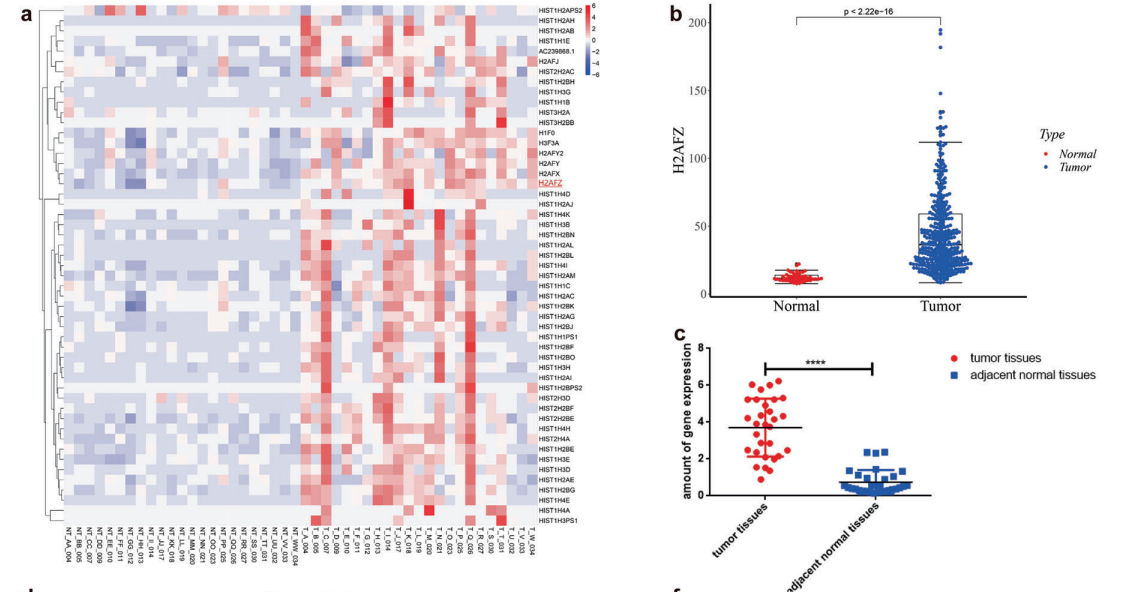
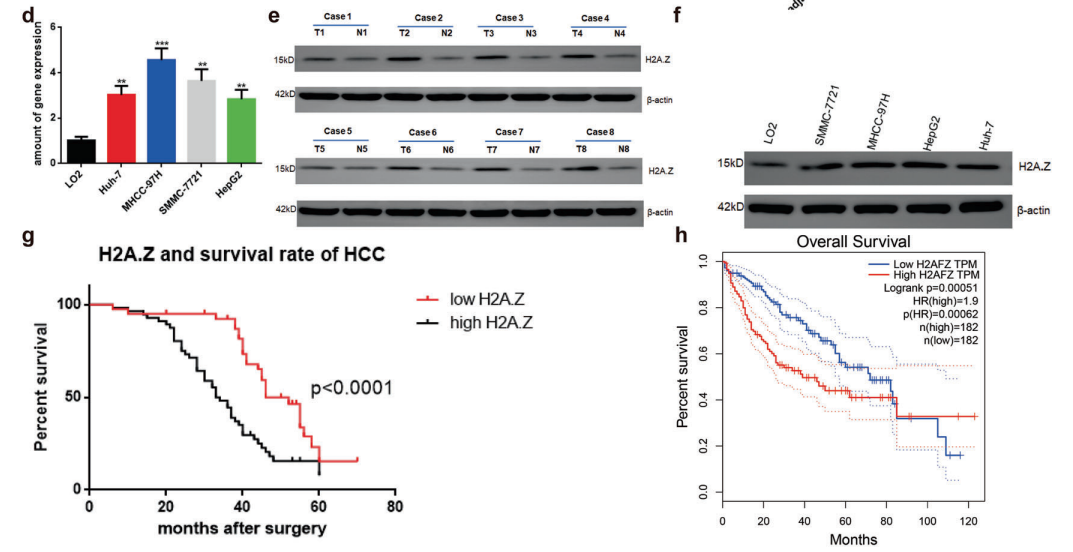
图1 H2A.Z在HCC组织和细胞中高度表达,与HCC患者的预后相关
2、H2A.Z促进肝癌细胞增殖,并且减少细胞凋亡,促进侵袭转移
研究采用敲除和过表达的方法来确定H2A.Z在HCC中的作用,并建立了敲除细胞株H2A.Z-knockdown 、过表达细胞株HepG2和MHCC-97H(图2A),H2A.Z过表达细胞的增殖能力提高(图2B),细胞迁移能力和侵袭能力明显增强(图2C、2D),细胞凋亡显著减少(图2E); 干扰H2A.Z后增殖能力降低,细胞迁移能力降低,侵袭能力明显降低,细胞凋亡增加。
18只裸鼠被随机分为三组,每组6只,空白质粒组,clone_H2A.Z和sh_H2A.Z(在肝癌细胞系中稳定表达)注入裸鼠腋窝观察致瘤性。结果发现,与空白质粒组相比,H2A.Z过表达组肿瘤明显变大,而干扰组肿瘤明显变小(图2F)。在转移小鼠模型中,对照组和sh_H2A肺表面未见结节,clone_H2A肺表面有结节。H2A.Z增强了体内肿瘤转移能力(图2G)。
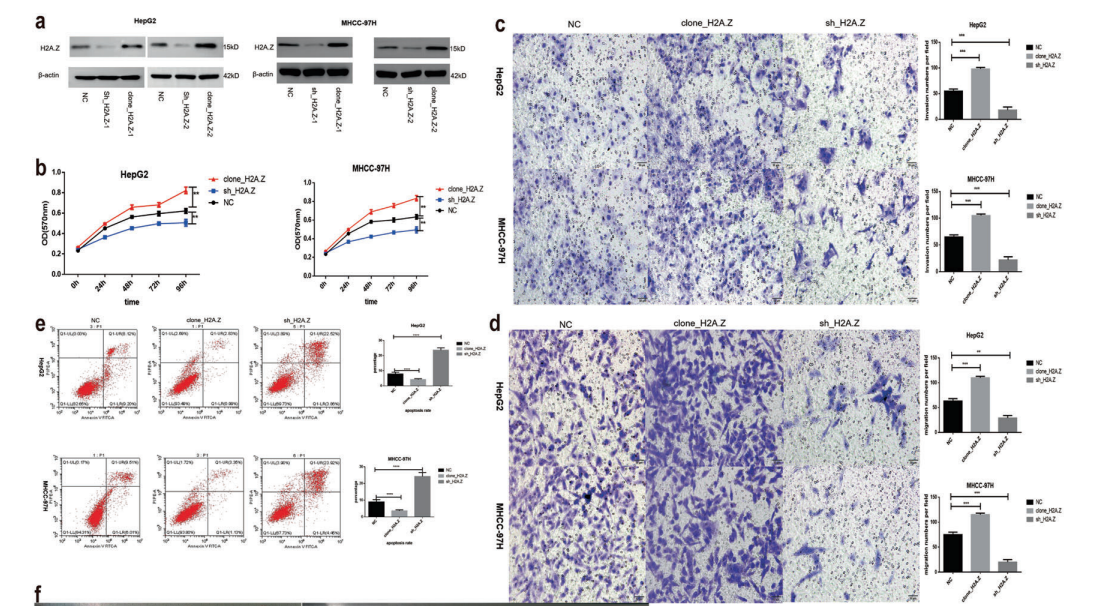
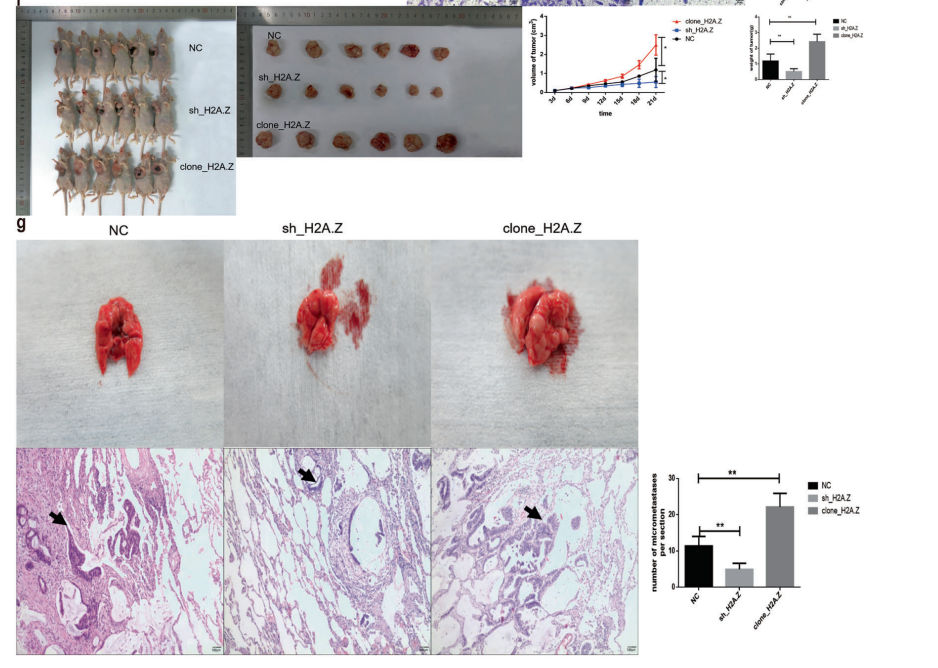
图2 H2A.Z对细胞生长的影响
3、H2A.Z通过癌症信号通路的转录失调影响肝癌细胞的增殖、凋亡、细胞周期和转移
为了深入了解H2A.Z调节肝癌细胞的特征,使用H2A.Z正常表达或敲低的肝癌细胞(HepG2)进行RNA-seq。在HepG2细胞中敲除H2A.Z,上调基因和下调基因的数量之比为279:356(图3A-B)。随后,基因集富集分析(GSEA)显示敲除H2A.Z后差异基因在细胞凋亡途径(图3C)、正向调控上皮细胞增殖和上皮细胞迁移通路(图3D-E)、C5_go_cell_cycle_DNA_replication通路显著富集(图3F)。分析证实了H2A.Z与肝癌细胞的增殖、凋亡、细胞周期、迁移、转移密切相关。
分析了H2A.Z的RNA-seq数据和源于ENCODE数据库的ChIP-seq数据。结果显示,两组有149个重叠基因,其中60个上调基因,89个下调基因(图3G)。对重叠基因进行KEGG功能富集分析,发现这些基因主要富集于癌症信号通路的转录失调(图3H)。进一步分析发现TCF3、CDK14、JUP、SPINT1、CDKN1A和IGF1是影响肿瘤细胞表型的下游靶基因(图3I)。ChIP-qPCR、HCC细胞系和裸鼠肿瘤的相关变化,结果与联合分析得到的结果一致(图3J-L)。
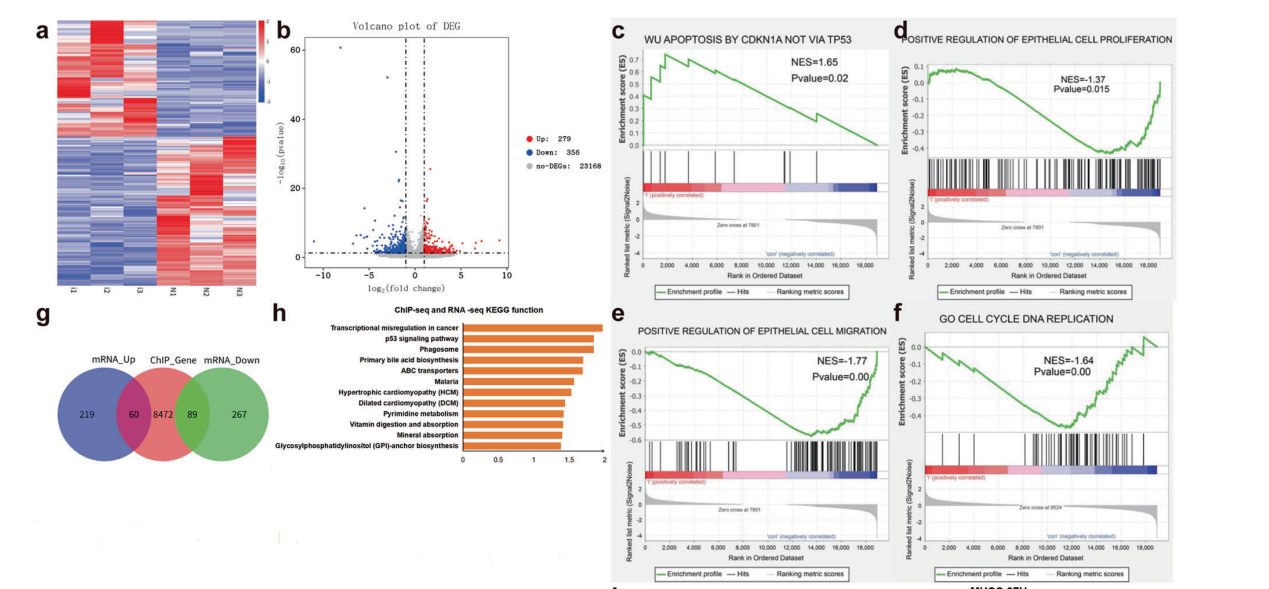
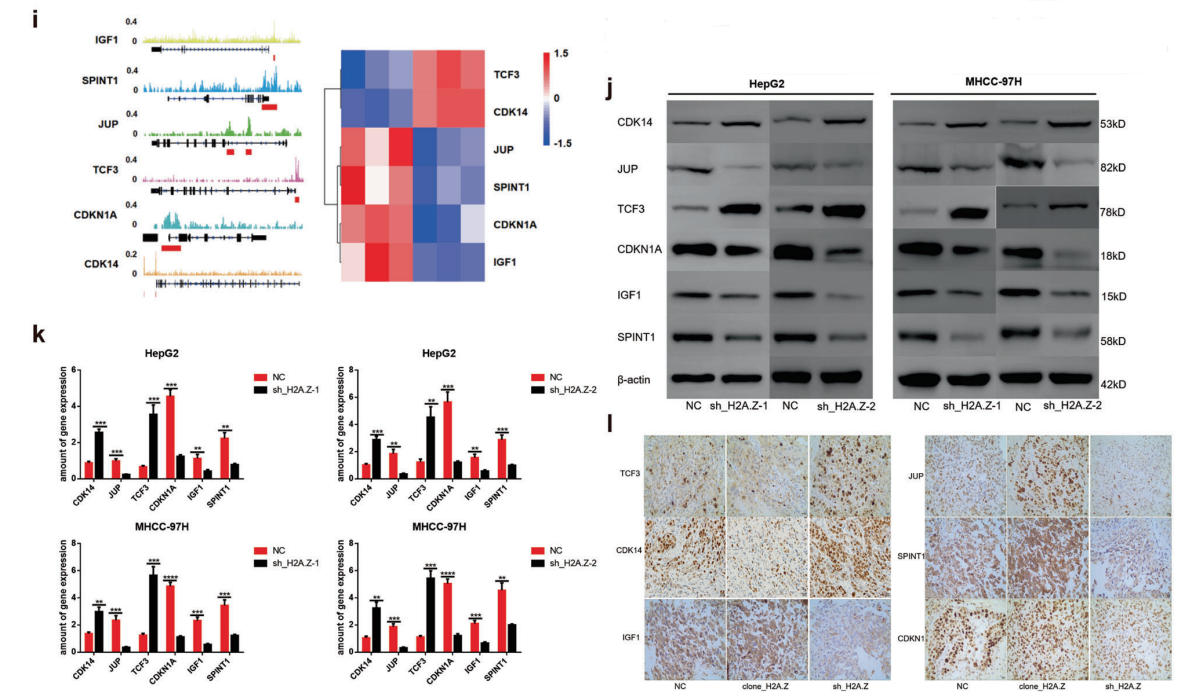
图3 H2A.Z通过在癌症信号通路中的转录失调发挥促肿瘤作用
4、BCL6是H2A.Z的主要相互作用蛋白,BTB和PHA03247是主要结合域
通过分析H2A.Z的ChIP-seq中的motif数据,结果表明BCL6最可能是H2A.Z的相互作用蛋白(图4A),在HepG2细胞系中证明了两种蛋白之间的相互作用(图4B)。组学分析结果表明BCL6能与相关下游基因的启动子区结合(图4D),在H2A.Z过表达的稳定细胞系中敲除BCL6,下游靶基因的变化与组学分析一致(图4E, F)。这些结果证实了BCL6与H2A.Z相互作用,进而影响下游基因的转录(图4C)。 Co-IP实验揭示了H2A.Z主要与BCL6蛋白的BTB和PHA03247结构域结合(图4H)。
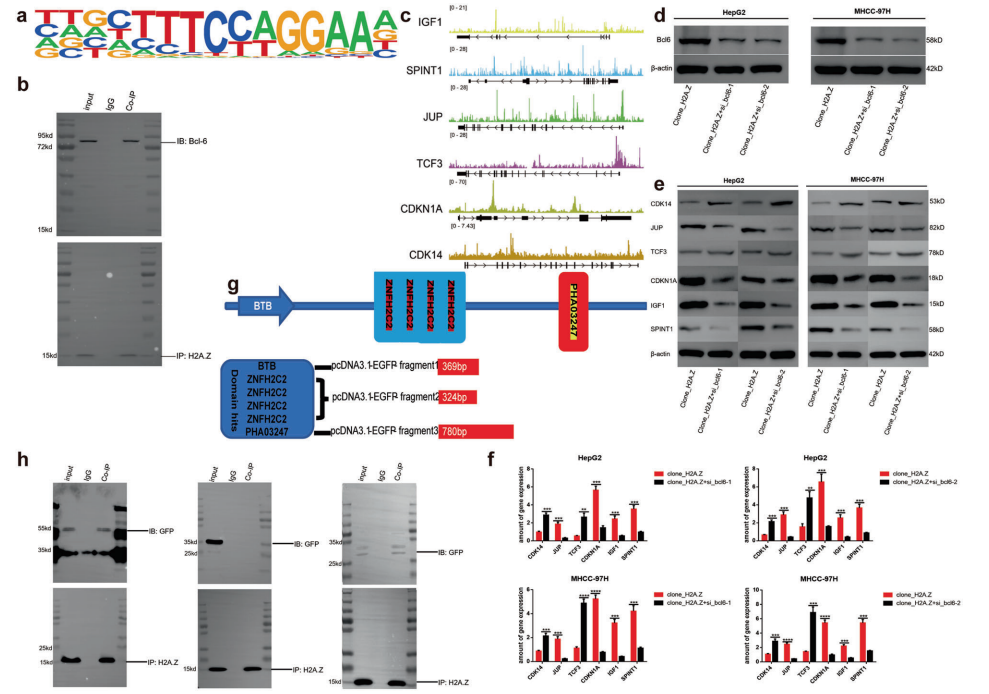
图4 BCL6是H2A.Z的主要相互作用蛋白,通过蛋白结构域BTB和PHA03247结合
5、H2A.Z乙酰化水平在HCC中显著升高
H2A.Z的ChIP-seq和RNA-seq联合分析发现H2A.Z-knockdown组的下调基因与ChIP-seq数据显著相关,因此认为H2A.Z主要起激活作用(图5A)。通过测定HCC细胞系和组织样本 发现两者中H2A.Z的乙酰化水平均显著升高(图5B-C),H2A.Z的高度乙酰化可能促进下游基因转录。
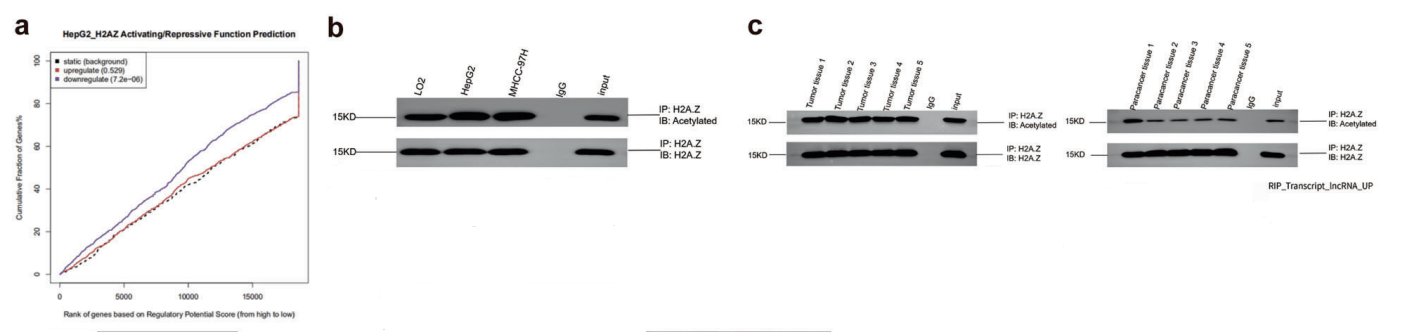
图5 LincZNF337-AS1与H2A.Z和H2A.Zac结合调控H2A.Z的乙酰化
6、LincZNF337-AS1与H2A.Z和H2A.Zac结合调控H2A.Z的乙酰化,并影响下游靶基因的转录
很多研究证据表明lincRNA在组蛋白的表观遗传修饰中发挥着重要作用。因此,对乙酰化H2A.Z进行了RIP实验,并对lincRNA进行测序。通过分析GEO数据和RIP -seq数据,获得了一个目标lincZNF337-AS1(图5D-H)。 RIP-qPCR证实lincZNF337-AS1确实与H2A.Zac和H2A.Z结合(图5I-J)。敲除lincZNF337-AS1后,细胞系中H2A.Z的乙酰化水平降低(图5K-L),说明lincZNF337-AS1调节H2A.Z的乙酰化。在H2A.Z过表达细胞株中敲除lincZNF337-AS1后。下游靶基因发生改变,进一步表明lincZNF337-AS1与H2A.Z结合影响下游基因的转录(图5M, N)。
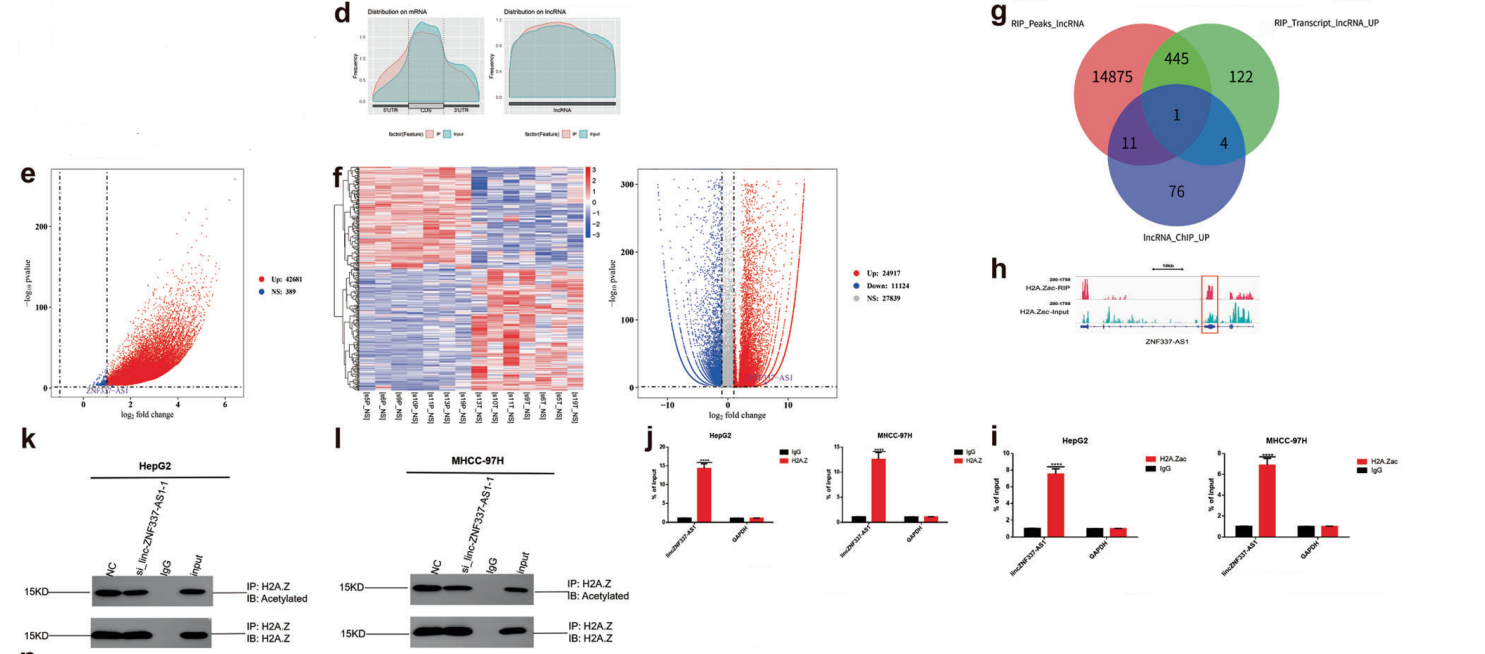
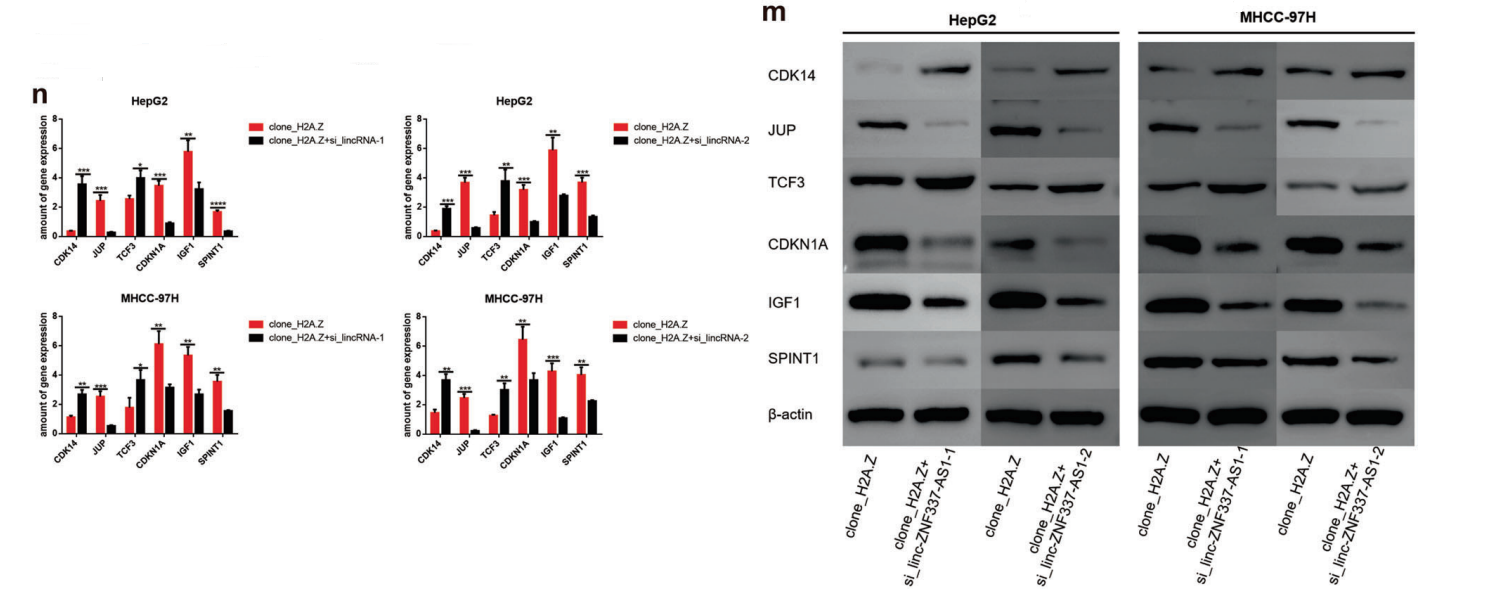
图5 LincZNF337-AS1与H2A.Z和H2A.Zac结合调控H2A.Z的乙酰化
预测lincZNF337-AS1与H2A.Z相互作用的区域,通过实验得到结合位点AS1(图6A-B),并采用RNA-pulldown进行了反向验证(图6C-D)。
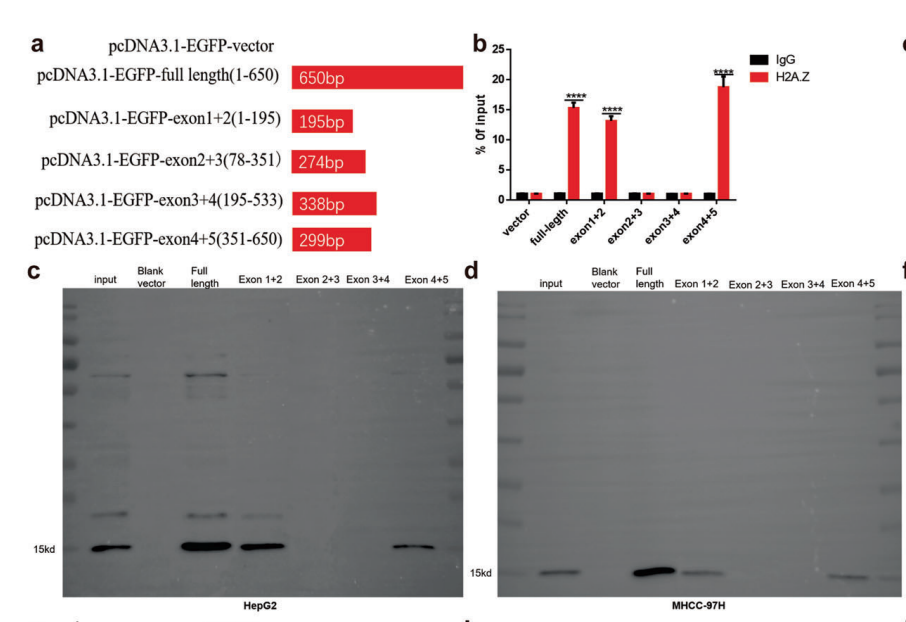
图6 lincZNF337-AS1与H2A.Z结合位点的鉴定
7、LincZNF337-AS1在HCC中高表达与H2A.Z的表达相关,并且与HCC患者预后不良相关
为了进一步明确lincZNF337-AS1在临床中的作用,并验证其与H2A.Z的相关性,用qPCR检测30个配对组织中基因的表达。结果显示lincZNF337-AS1在HCC中高表达(图6E),且表达与H2A.Z呈正相关(图6F)。在96例临床HCC标本中,lincZNF337-AS1高水平表达,患者预后较差(图6H)。此外,lincZNF337-AS1水平与H2A.Z呈正相关,与HCC患者的总生存期呈负相关(图6I, J)。敲低lincZNF337-AS1后肿瘤细胞的克隆能力(图6K)和增殖能力(图6L)下降,可能是影响了下游关键基因的表达。
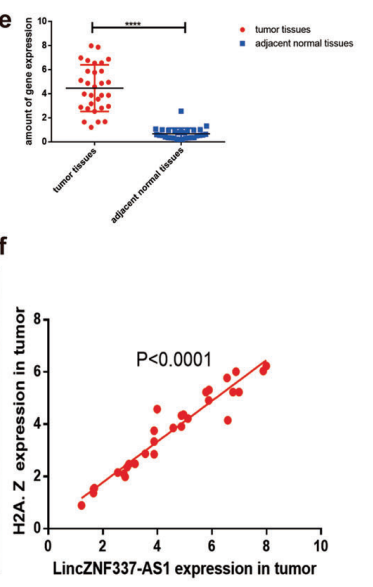

图6 lincZNF337-AS1与H2A结合位点的鉴定,lincZNF337-AS1在HCC中表达水平的鉴定及其与HCC患者预后的关系。
8、LincZNF337-AS1通过KAT5促进H2A.Z乙酰化
为了验证乙酰转移酶是否参与了lincZNF337-AS1调控H2A.Z乙酰化过程,RNA-pulldown和RIP-qPCR实验结果显示lincZNF337-AS1与KAT5结合(图7 A - C)。敲除了HCC细胞系中的KAT5后,H2A.Z乙酰化显著降低(图7E-F)。RNA-pulldown结果显示KAT5与lincZNF337-AS1的作用位点与H2A.Z的结合位点不同(图7G-H)。在HCC细胞系中敲除lincZNF337-AS1的表达时,H2A.Z和KAT5的相互作用明显降低(图7I)。
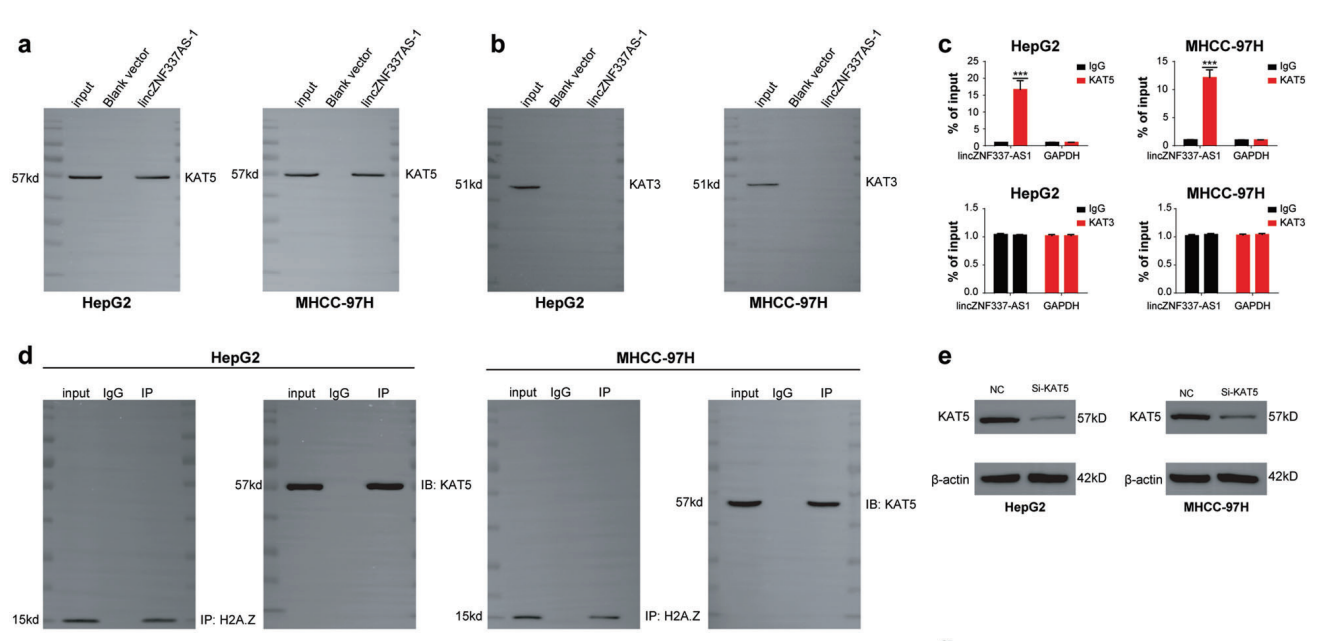
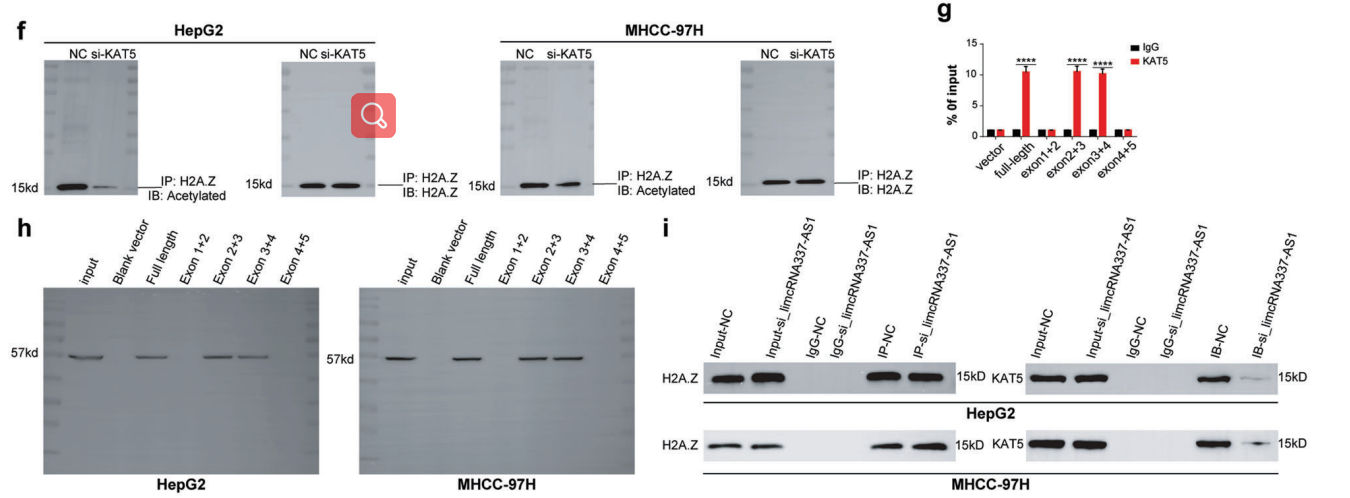
图7 LincZNF337-AS1通过KAT5促进H2A.Z乙酰化
三、研究结论
本研究结果证实了H2A.Z对肝癌细胞(HCC)增殖、转移、凋亡及细胞周期的影响,H2A.Z与BCL6相互作用,通过肿瘤失调信号通路发挥作用。此外,在肝癌细胞(HCC)中H2A.Z乙酰化水平较高,与肿瘤形成有关。H2A.Z的乙酰化受lincZNF337-AS1调控,LincZNF337-AS1与H2A.Z和KAT5结合在不同位点,通过KAT5促进H2A.Z的乙酰化。本研究认为,在肝癌细胞(HCC)中,H2A.Z是一个癌基因,受lincZNF331-AS1调控,其乙酰化可以促进下游基因的转录。
参考文献:
H2A.Z acetylation by lincZNF337-AS1 via KAT5 implicated in the transcriptional misregulation in cancer signaling pathway in hepatocellular carcinoma.[J]Cell Death and Disease, 2021.