2022年发表于《JCI Insight》(IF =9.7)
一、研究框架
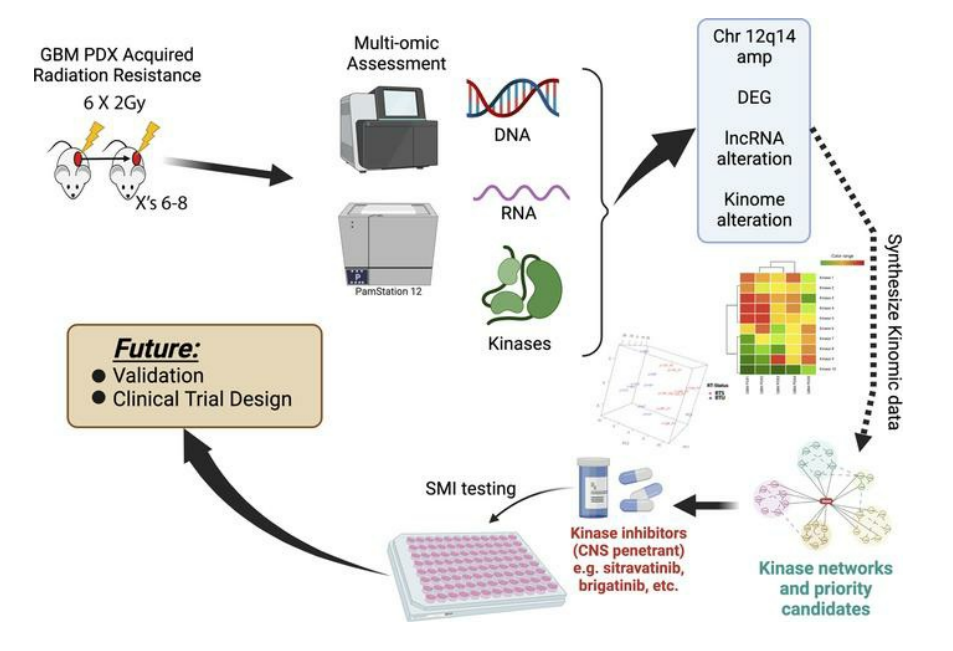 二、研究背景
二、研究背景
胶质母细胞瘤(GBM)是最常见、最具破坏性的原发性脑癌。GBM几乎总是会复发,并且复发肿瘤经常对常规治疗产生获得性耐药。最近两项关于胶质瘤的研究报告表明,选择压力和驱动突变往往发生在胶质瘤发生的早期,复发后基因组水平的变化很少。这可能说明了,获得性治疗耐药等表型变化并非由基因组水平驱动,而是由表观遗传、转录组学和翻译后水平驱动。为此,本研究进行了全外显子组测序(WES)和深度RNA测序(RNA- seq),其中RNA- seq中包含了长链非编码RNA (lncRNA)在内的转录本。lncRNA可以作为微小RNA或转录因子的分子海绵,增强子或抑制复合物的支架,染色质重塑酶的向导,或者作为基因激活的信号。全基因组泛癌症分析联盟最近确定了122个在癌症发生中起重要作用的lncRNA,其中一些本研究的结果重叠。
为了识别lncRNA和其潜在靶点,本研究设计了一种计算机模拟方法。还将传统的差异基因表达分析(DE)与差异基因相关分析(DGCA)、机器学习和语义网络构建相结合,以进一步阐明治疗抗性产生的转录机制。经典DDR通路在体内转录组水平的差异富集。许多lncRNA与这些通路中转录本的差异表达相关。
通过整合激酶组学(kinomic)和转录组数据来评估RTS模型,以识别辐射诱导的信号传导和表达的变化。在肿瘤中,激酶信号具有高度的治疗靶向性,而且放射治疗已被证明通过调节Src和原肌球蛋白受体激酶(Trk)家族激酶信号等诱导恶性表型。本研究的结果表明,选择放疗诱导了可靶向的激酶活性改变。临床上使用的已知脑穿透的小分子抑制剂(SMIs)西拉替尼和布加替尼在RTS GBM模型中有效。临床相关模型的综合信息的分析应用,为难治性肿瘤选择临床前治疗提供了一种方法。
三、研究结果
1、GBM PDXs在体内的连续辐射产生RTS衍生物
对20个GBM 异种移植(PDX)进行了放射敏感性筛查。使用卡尺在体外测量肿瘤生长情况,如果初始肿瘤体积的中位倍增时间显著小于20天,则将放疗反应定义为“抵抗”(n = 8),如果倍增时间大于20天,则定义为“敏感”(n = 10),如果与20天无显著差异,则定义为“中等”(n = 2)(图1A)。对11个PDXs (RTU)进行了针对放射治疗的连续体内选择(6-8连续传代)(图1B)。图1C显示了敏感的RTU线(蓝色实线)及其配对的耐药(RTS)(红色虚线)倍增时间差异。选择其中8个PDXs,测定了肿瘤倍增时间(图1D)。图1E显示了基本临床信息(图1E)和图1F展示了GBM驱动基因。
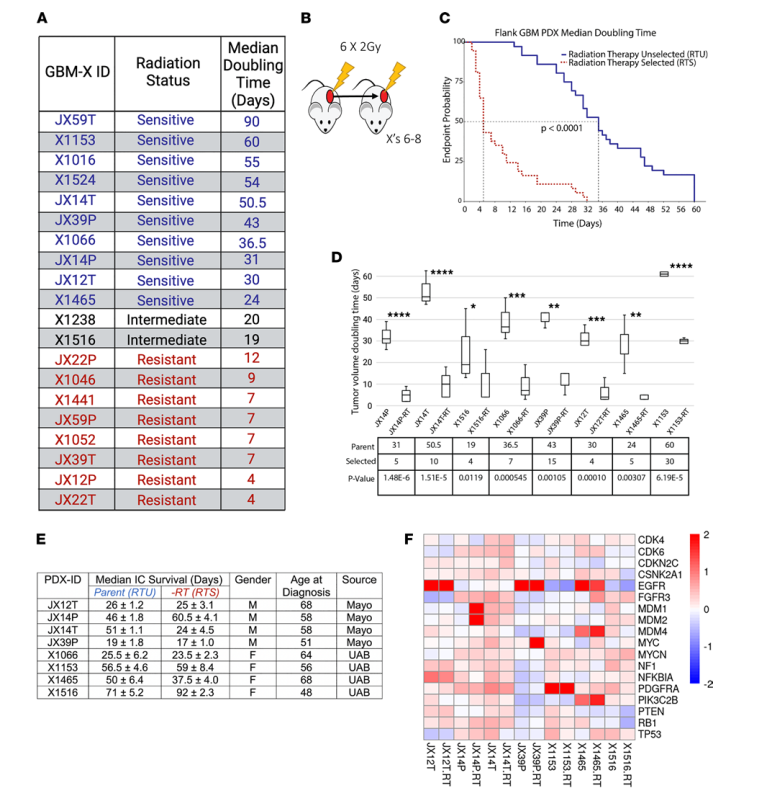
图1 GBM PDX 选择的模型表现出生存和分子多样性的差异
2、在一些RTS PDXs中发现了染色体12q14扩增
SNP分析表明,RTS PDX系与其亲本RTU系高度相关(图2A)。与GBM标志性驱动基因所展示的结果一样,RTS PDX系通常保持其典型的基因组变异。然而,研究发现8个RTS系中的2个(X1153-RTS和JX14P-RTS)在染色体12q14上有拷贝数扩增(图2B)。虽然12q扩增可能与RTS细胞系获得性辐射抗性有一定关联,但转录组和激酶组的评估可能会更有意义。
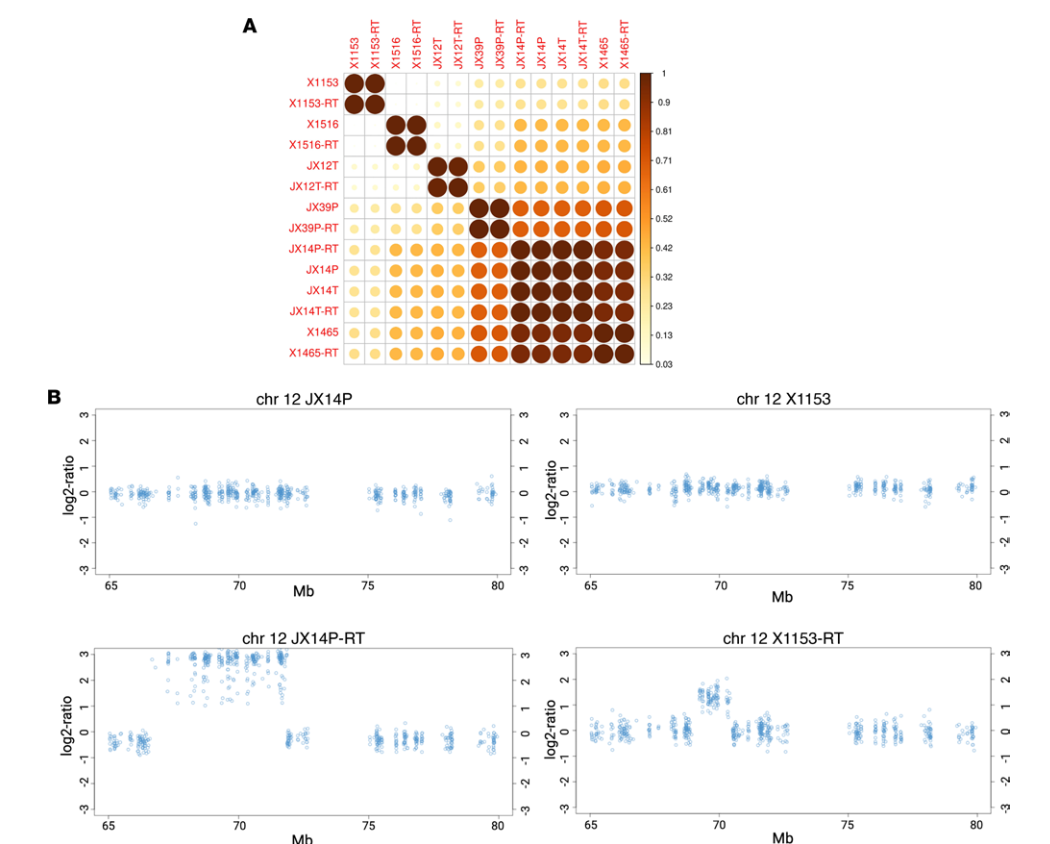
图2 GBM PDX-RT模型的染色体12q14扩增鉴定
3、转录组学分析确定了可能具有功能的lncRNA
建立颅内原位异种移植瘤模型,获取肿瘤进行组学分析(32个)。每个原位肿瘤被分成两部分用于激酶组学和转录组学研究。结果揭示了482个显著差异表达基因(DEGs)(图3B),包括69个lncRNA和24个假基因。在不将患者肿瘤来源作为协变量的情况下,合并RTU与RTS 揭示了27个显著的DEGs(图3C),包括5个lncRNA和1个假基因。其中一个lncRNA是癌症易感性19 (CASC19/PCAT2)。
建立颅内原位异种移植瘤模型,获取肿瘤进行组学分析(32个)。每个原位肿瘤被分成两部分用于激酶组学和转录组学研究。结果揭示了482个显著差异表达基因(DEGs)(图3B),包括69个lncRNA和24个假基因。在不将患者肿瘤来源作为协变量的情况下,合并RTU与RTS 揭示了27个显著的DEGs(图3C),包括5个lncRNA和1个假基因。其中一个lncRNA是癌症易感性19 (CASC19/PCAT2)。
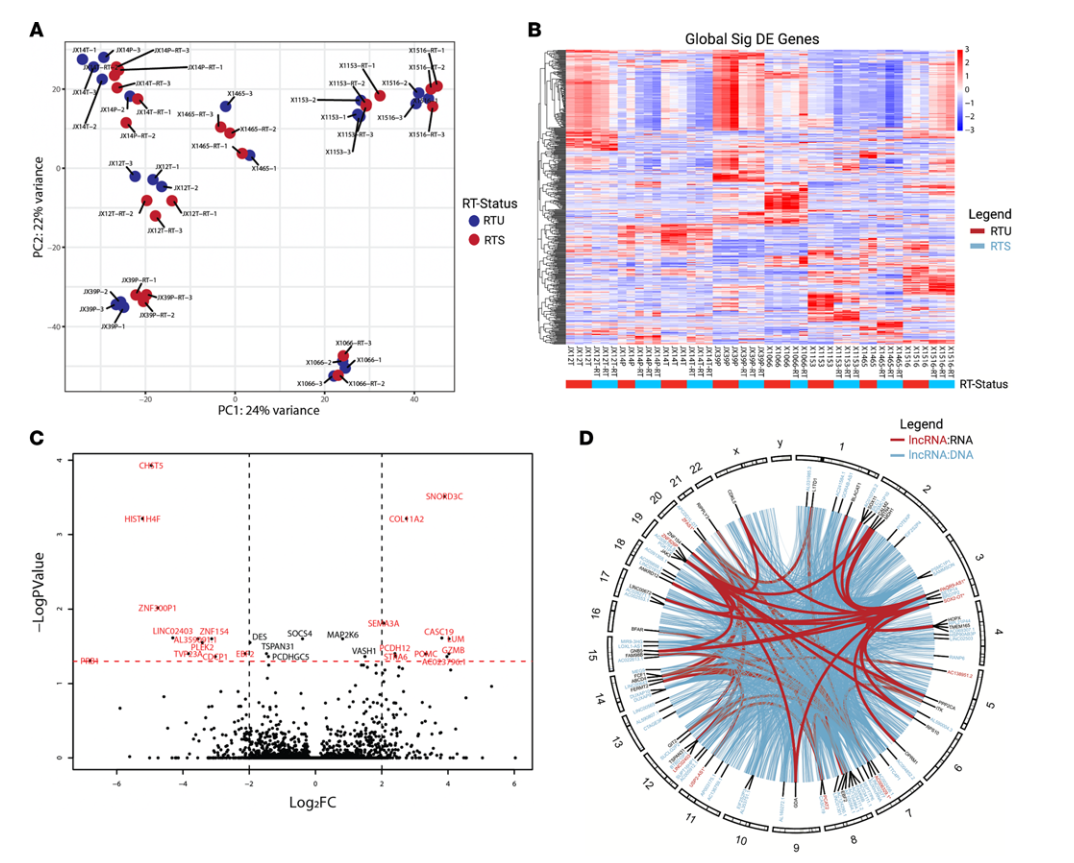
图3 GBM PDX根据患者肿瘤来源进行大致分离,RTU和RTS之间有少量显著差异表达基因
4、获得性耐辐射肿瘤表现出明显的DDR(DNA损伤应答)通路改变
抗辐射的标志之一是DDR活性增加或改变。图4 A-F显示了RTS与RTU PDX在12个DDR转录特征上的标准化富集分数。由于重复数量不平衡,无法生成JX12P、X1465或X1066的归一化富集分数。其中JX12T对与其他RTS PDX差异最大,与RTU PDX相比,RTS的所有12个DDR特征标准化富集分数都降低了(图4C)。
一些lncRNA与DDR基因的显著差异表达有很强的相关性。在X1153对中,AC008764.8与FA相关基因FANCC呈负相关(图4F),AC124290.1和AUXG01000058.1与HR相关基因SEM1呈强正相关(图4F)。SOX2-OT与NHEJ相关基因XRCC4呈正相关,与RAD9A的相关性较低。AC002456.1与HR相关的RBBP8呈负相关(图4E),与NER相关的MNAT1和NHEJ相关的XRCC5呈正相关。
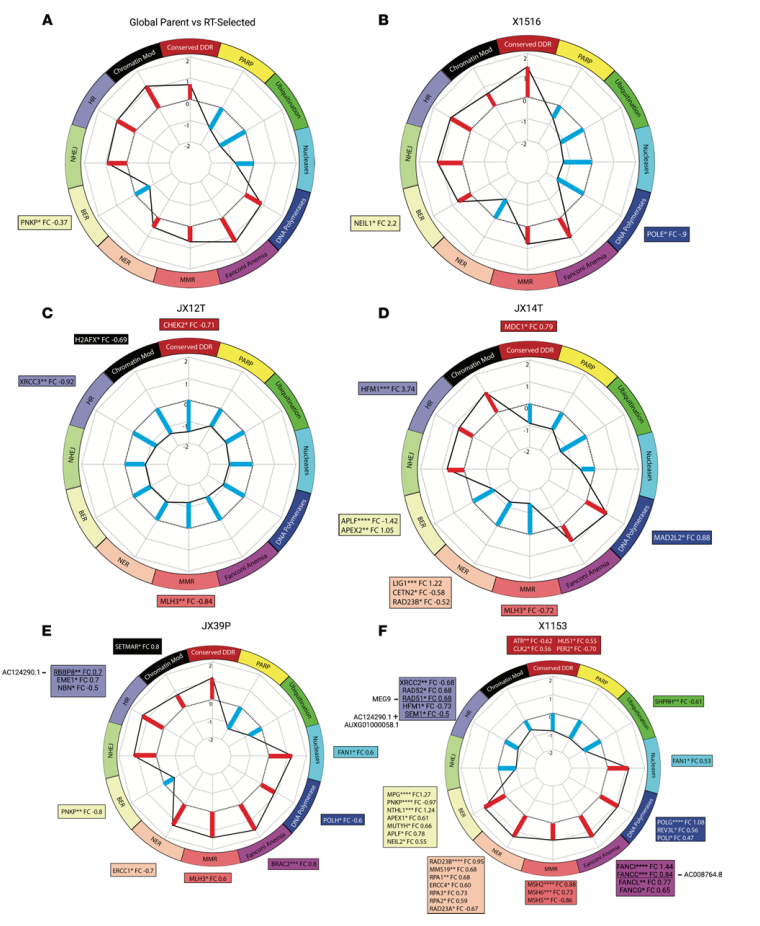
图4 PDX对DDR通路的差异富集及其对DNA损伤的响应
5、Kinome分析识别RTS PDX定的作用目标
RTU和RTS对的动力学分析揭示了激酶信号的共同和PDX特异性改变。激酶组学分析主要通过抗性状态(RTU或RTS)来分离PDX(图5A和B),总体而言,RTS比RTU中的激酶信号传导减少。接下来,在通路水平上分析上游激酶单独以及与差异调节的lncRNA:DNA结合近端基因的整合。在JX14P和JX39P的整合分析中,Src家族激酶活性在RTS中上调,而在X1153和X1465 RTS中降低。出于对药物靶点评估的兴趣,重点关注那些在RTS PDX中表现出活性增加的激酶。
为了测试图5C-E和补充数据4中活性增加的激酶的药物潜力,在PDX衍生的神经球培养中使用西拉替尼(sitravatinib)和布加替尼(brigatinib)进行体外SMI筛选。西拉替尼(sitravatinib)靶向TRKA/B (JX14P-RTS, JX39P-RTS), ROS1 (JX14T-RTS), Src (JX14P-RTS, JX39P-RTS),以及多种Ephrin亚型。布加替尼(brigatinib)靶向ROS1 (JX14T-RTS)和典型GBM靶向EGFR (JX39P-RTS)。观察到JX14T-RTS、JX39P-RTS和JX14P-RTS对西拉替尼和布加替尼均显著敏感(图5F)。
对JX14P、JX14T、JX39P和X1465的配对RTU和RTS进行验证性Western blot分析。如图6A和B所示,JX14P、JX14T和JX39P的RTS系表现出多种激酶和/或激酶靶点的磷酸化增加,包括Src家族激酶(SFKs)(图5)。然而,X1465-RTS与RTU系相比,除了STAT2 (Y689)和AKT (S473)轻微升高外,磷酸化水平降低或没有明显变化。
从先前的动力学筛选中验证的活性增加最多的激酶,包括增加的Hck, Yes1和Src (JX14P-RTS)、增加的Lyn和Src (JX39P-RTS)、增加的JNK2 (X1465-RTS)。在4个RTS系中的3个系中,Src家族、PIM家族、MSK1、PYK2和JNK激酶的活性增加。此外,BRK在JX39P-RTS中作为顶端激酶被激活,并且与亲本RTU系相比,BRK在JX14P-RTS和JX14T-RTS中得分较高。
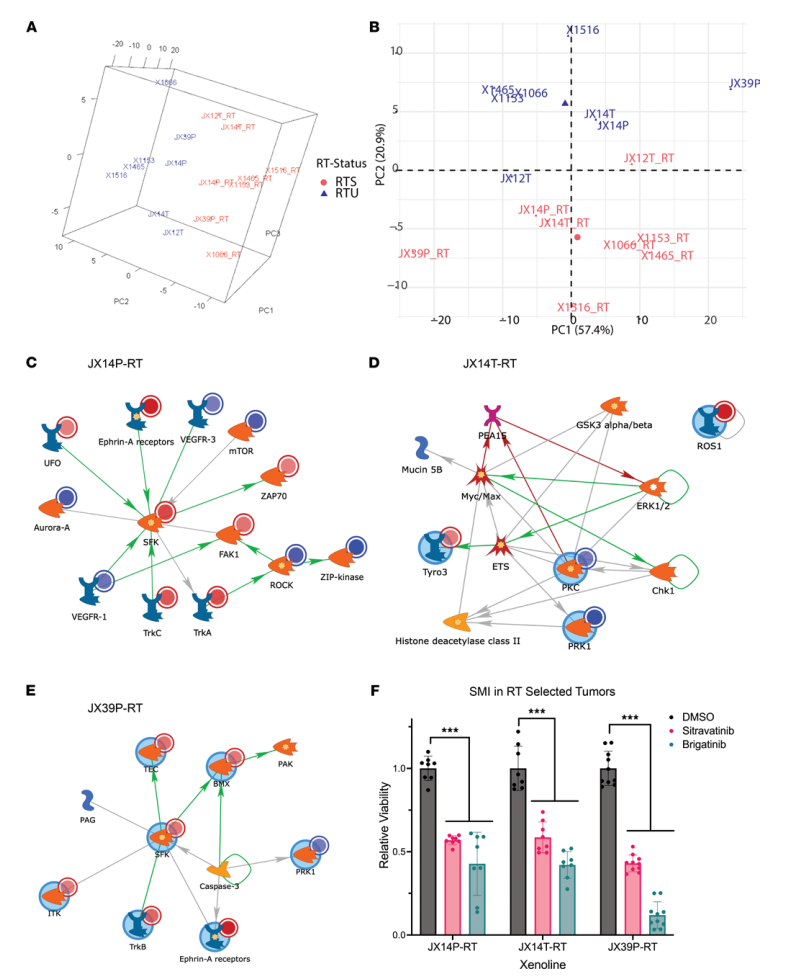
图5 SMIs靶向RTS的激酶信号通路改变
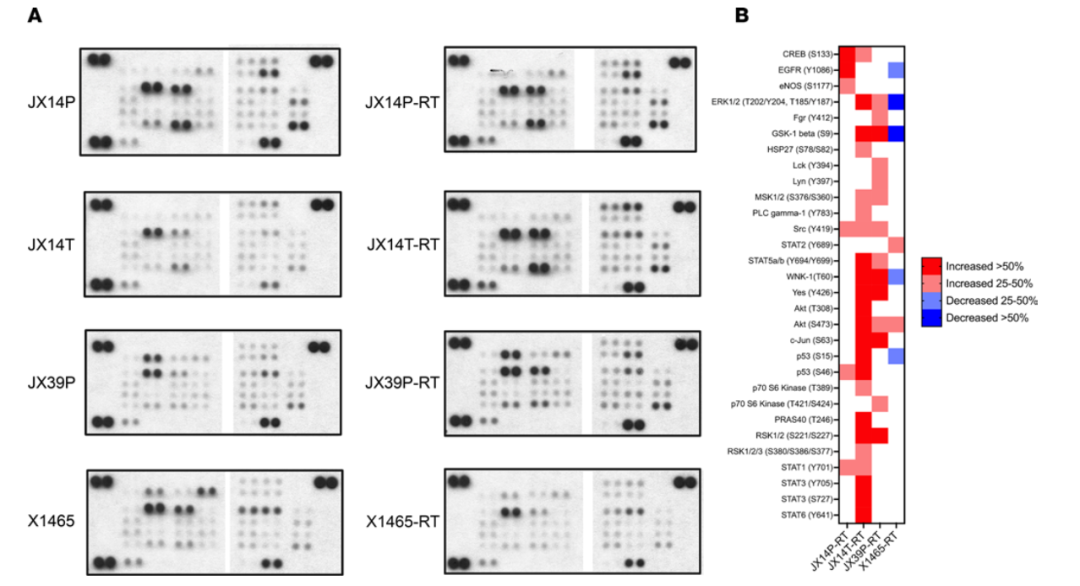
图6 Phospho-kinase Western blot显示GBM PDX-RTS对中存在差异磷酸化蛋白
四、研究结论
通过构建8个GBM的异种移植(PDX)模型,包含获得性放射治疗耐药性(RTS)与辐射敏(RTU)。这些可能独特的模型模拟了连续放射治疗后患者复发肿瘤的纵向演变。事实上,虽然全外显子组测序显示RTS系中保留了主要的基因组改变,但我们确实在2个RTS模型中检测到与临床GBM复发相关的染色体12q14扩增。一种潜在的新型生物信息学管道被应用于分析表型、转录组学和基因组学变化,其中鉴定了长链非编码RNA (lncRNA)和可靶向的特异性激酶。我们在RTS模型中观察到DNA损伤修复通路的差异转录富集,这与几种lncRNA相关。RTU和RTS模型的整体基因组图谱分离,但两两分析表明,获得性辐射抗性存在多种分子途径。鉴定出RTS模型特异性激酶,并用临床相关的小分子抑制剂靶向。这组体内RTS患者衍生模型能帮助未来的临床治疗克服GBM患者的治疗耐药性。
参考文献:
An in vivo model of glioblastoma radiation resistance identifies long noncoding RNAs and targetable kinases.[J]JCI Insight, 2022.
...........................................................................................................................................................................................








