2023年发表于《Cell Metabolism》(IF =35.1)
一、研究背景
非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)的患病率比较高,据报道NAFLD的总患病率为32.4% ,NASH患病率估计为1.5% ~ 6.5% 。在NASH潜在疗法的临床前研究中,小鼠模型不能准确模拟人类疾病,也不能在临床上转化。因此,通过使用更易于转化为人类NASH的稳健临床前模型,可以显著提高临床试验的成功概率。
最近的研究发现,甘氨酸代谢受损是NASH和相关心脏代谢疾病的致病因素和治疗靶点。利用NAFLD和NASH小鼠模型,发现DT-109,一种基于甘氨酸的三肽(Gly-Gly-Leu),它通过诱导脂肪酸(FA)降解和通过谷胱甘肽(GSH)从头生物合成的抗氧化来降低脂肪性肝炎和肝纤维化。为了提高DT-109临床试验的成功概率,在本研究中,评估了DT-109的剂量反应,并在猕猴中测试了其疗效和安全性。进一步应用转录组学、蛋白质组学、代谢组学和宏基因组学的多组学方法,发现DT- 109不仅通过促进肝脏FA降解和GSH生成,还通过调节微生物胆汁酸(BA)代谢,从而逆转食蟹猴的肝脂肪变性,抑制肝脏炎症和纤维化的进展。
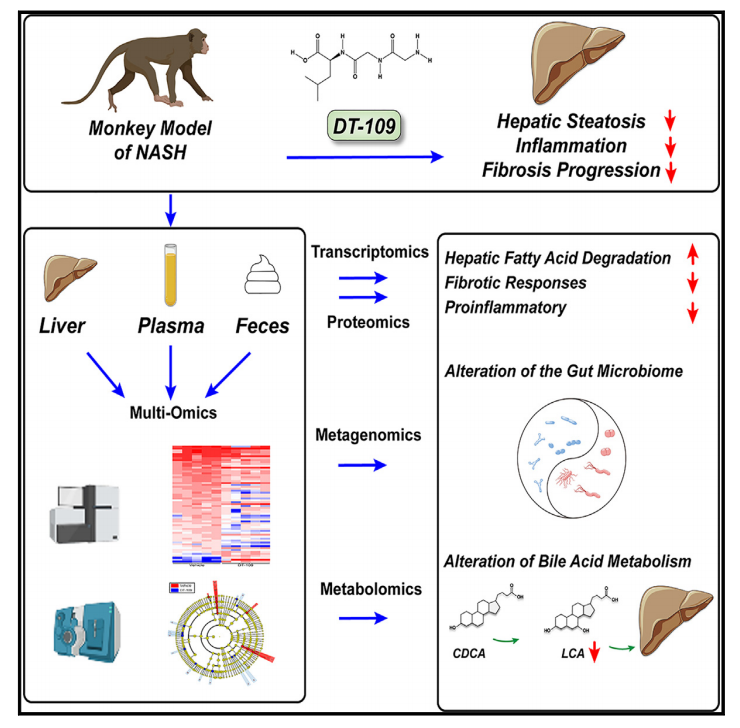
图1 研究框架图
二、研究结果
1、DT-109剂量依赖性的改善小鼠非酒精性脂肪性肝炎(NASH)
小鼠随机分组,分别以15、45、150和450 mg/kg/d的剂量或H2O(溶剂)在NASH饮食中口服DT-109 12周。喂食标准饮食(SD)并给予H2O的小鼠作为对照(图1A)。DT-109治疗减轻了NASH饮食诱发的肝肿大,导致肝/体重比(图1B)出现剂量依赖性降低,450 mg/kg/d时效果最显著。与NASH组小鼠相比,给予450毫克/公斤/天的DT-109治疗可使肝体重比降低31.1% (p = 0.0001;图1B)。肝脏大体形态(图1F)以及组织学和生化分析(图1G-1K)证实肝损伤减轻,表明肝肿大、脂肪性肝炎和纤维化减轻。与接受溶剂的NASH饮食小鼠相比,450 mg/kg/d的DT-109显著降低了脂肪变性评分,总体NAS评分和纤维化评分。总之,这些发现表明,DT-109治疗可剂量依赖性地降低小鼠饮食诱导的NASH和肝纤维化,450 mg/kg/d是最有效的剂量。
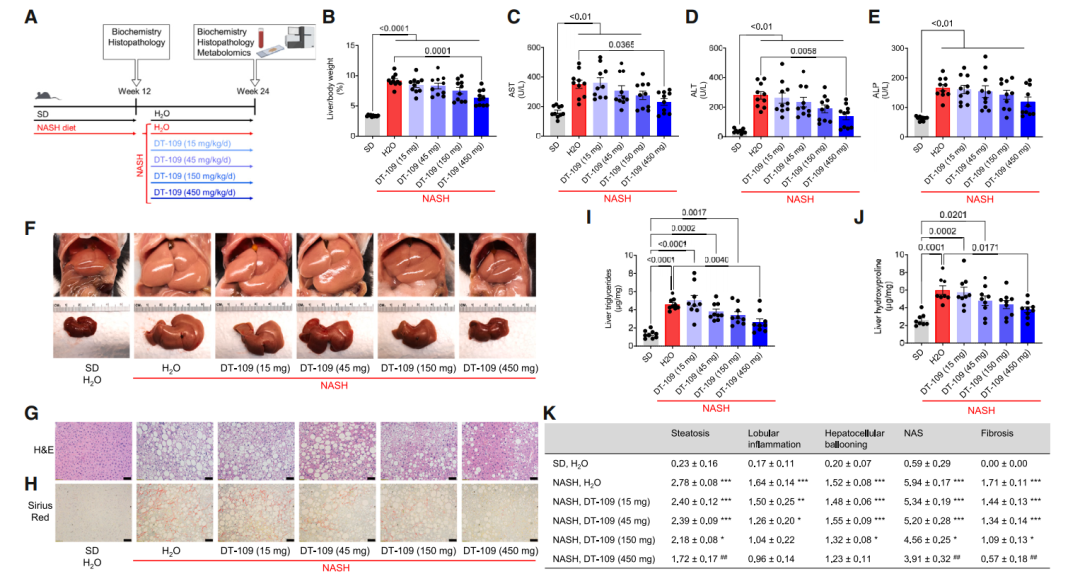
图2 DT-109剂量依赖性的改善小鼠NASH
2、在非人类灵长类动物中建立模仿人类疾病的NASH模型
为了开发具有高度可转化性的NASH临床前模型,筛选了20只NASH易感性的猴子(图2A)。然后向猴子喂食新开发的NASH饲料。NASH饮食10个月后,肥胖指数(图2B),腹围(图2C)、腰围(图2D)、肝损害(AST,图2E)等显著增加。此外,为评估非人灵长类动物模型与人类NASH之间的相似性,本研究将NASH饮食10个月前和10个月后猕猴肝脏中前100个差异表达基因(DEGs),与来自NASH患者和非NASH患者肝脏样本的两个独立队列进行了比较。通路富集分析表明,NASH中的通路类似并且显著上调或下调(图2I)。使用另一个由206例肝移植供体样本组成的队列,比较了在食蟹猴模型和人类中,与NASH相关并与肝脂肪变性相关的关键基因(图2J)。
研究发现,一些基因通过诱导FA降解起到保护肝脏的作用(如PPARA),在NASH猴子和人体中均显著下调并且与肝脂肪变性呈负相关。相反,一些基因可通过促炎和促纤维化信号通路促进NASH的基因表达(例如NLRP3和TGFB1)。在猴子和人体中都显著上调且与肝脂肪变性呈正相关。
因此,通过筛选有NASH易感性的猴子,利用新开发的NASH饮食,并结合生化、组织学和转录分析,建立了NASH模仿人类的食蟹猴模型。
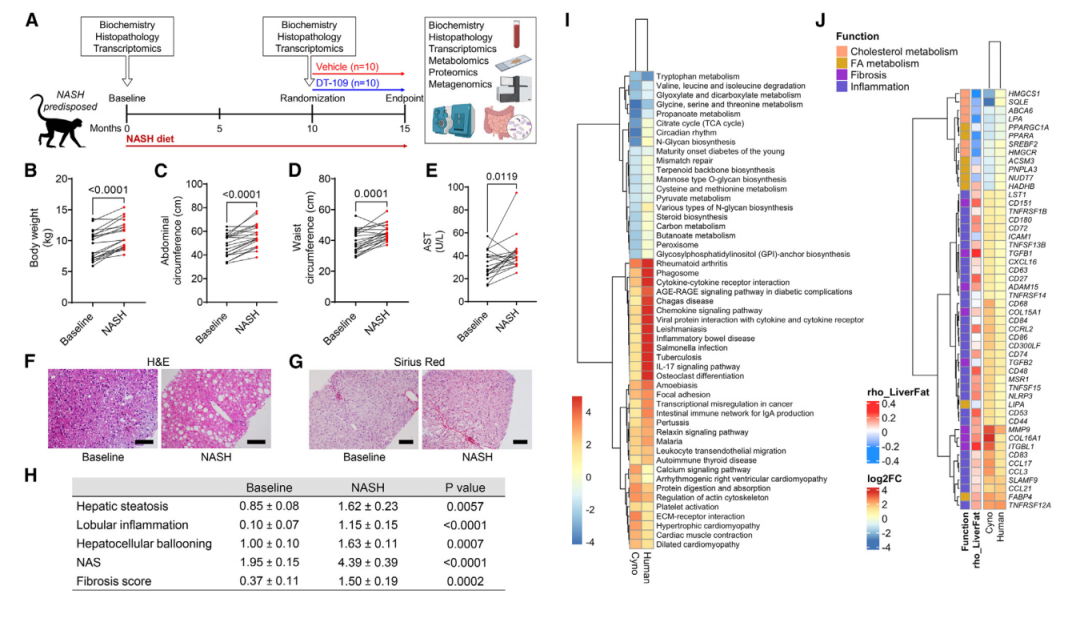
图3 在非人类灵长类动物中建立模拟人类疾病的非酒精性脂肪性肝炎模型
3、DT-109在非人类灵长类动物NASH中逆转肝脂肪变性,防止炎症和纤维化进展
接下来,以150 mg/kg/天的DT- 109剂量给药,H2O作为实验对照。DT-109治疗组和对照组猴子的体重(图3A)、腹围(图3B)和腰围无显著差异。通过循环转氨酶对肝损伤的评估(图3C-3E)显示,DT-109治疗的猴子AST和ALP 显著降低。组织学分析(图3G-3I)证实,DT-109治疗的猴子肝脂肪变性、肝细胞气球样变、总体NAS和纤维化评分显著降低。在干预研究的5个月期间,对照组的小叶炎症、NAS 和肝纤维化显著增加。与治疗前相比,DT-109治疗可显著减少肝脂肪变性(p = 0.0156)。综上所述,结果表明,DT-109通过逆转肝脏的功能来改善非人灵长类动物的脂肪变性,防止炎症和纤维化的进展。
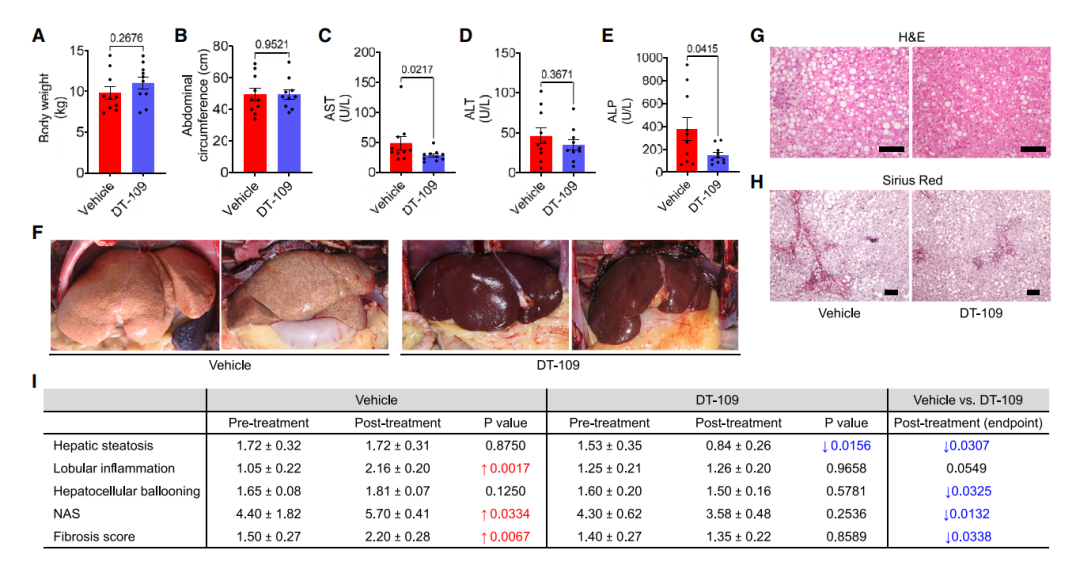
图4 DT-109可逆转饮食诱导的脂肪变性,并阻止已确诊NASH的非人灵长类动物的肝脏炎症和纤维化进展
4、转录组学和蛋白质组学揭示了DT-109诱导肝脏脂肪酸降解和抑制促炎/纤维化反应
为了阐明DT-109改善非人灵长类动物NASH的潜在机制,应用了转录组学、蛋白质组学、代谢组学和宏基因组学等多组学方法。首先,对终点时采集的肝脏样本进行了RNA测序。主成分分析(PCA)显示,DT-109治疗组猴子和对照组的肝脏转录组明显分离(图4A), DT-109显著下调了575个DEGs,显著上调了391个DEGs(图4B)。因此,通路富集分析(图4C和4D)表明,与在NASH患者和猴中观察到的应答相比,DT-109治疗诱导了相反的应答。特别是在NASH中受到抑制的甘氨酸、丝氨酸和苏氨酸代谢通路以及色氨酸代谢通路在接受DT-109治疗的猴子的肝脏中显著上调,同时FA降解通路上调(图4C);NASH中上调的细胞因子-细胞因子受体相互作用通路、趋化因子信号传导和ECM -受体相互作用通路受到抑制,同时局部黏附和细胞黏附分子通路下调(图4D)。
通过比较转录组和蛋白质组数据,结果显示FA降解和甘氨酸、丝氨酸和苏氨酸代谢是DT-109上调的最主要通路,而趋化因子信号传导、黏着斑和ECM -受体相互作用是下调的最主要通路(图4F)。接下来,使用组织学和生化方法证实了这些通路改变后的结果(图4G -4L)。因此,结合转录组学和蛋白质组学以及组织学和生化验证,发现DT-109在NASH非人灵长类动物中诱导FA降解并抑制促炎和纤维化反应。
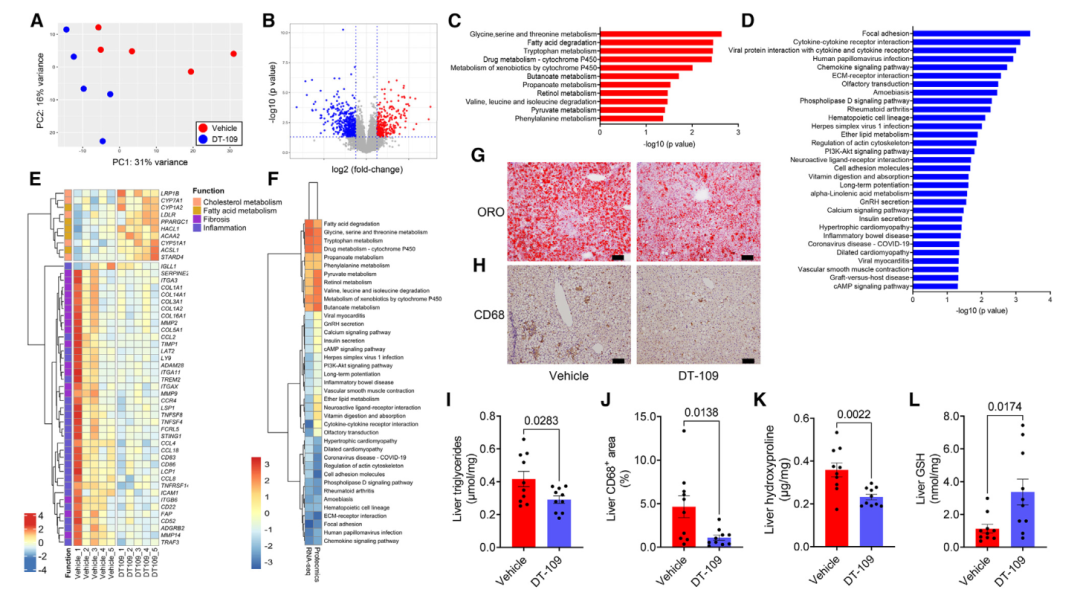
图5 转录组学和蛋白质组学揭示了DT-109诱导肝脏脂肪酸降解和抑制促炎/纤维化反应
5、非靶向和靶向代谢组学显示DT-109抑制胆汁酸代谢
为了进一步探索DT-109改善非人灵长类动物NASH的代谢机制,进行了非靶向和靶向代谢组学(图5A)。PCA和OPLS-DA分析表明,DT-109组猴子和对照组的血清中,存在不同的代谢组(图5B和图5C)。通路分析显示,BA生物合成途径中最显著的富集(图5D), DT-109处理后BA总体减少(图5E)。非靶向代谢组学结果显示,石胆酸(LCA,p = 0.0002)、甘氨酸(GLCA,p = 0.0014)和牛磺酸(TLCA,p = 0.0038)等BAs显著降低(图5F),并进行了靶向代谢组学验证(图5G)。总之,非靶向和靶向代谢组学显示,DT-109治疗抑制了NASH个体的BAs代谢,其中对继发性和肝毒性BA、LCA的抑制最为显著。
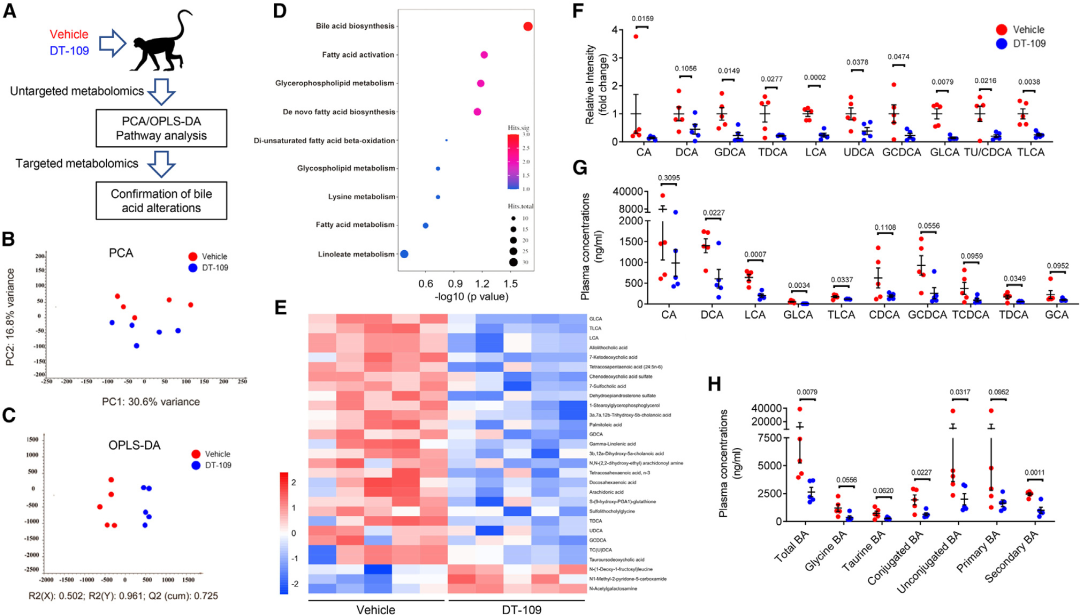
图6 非靶向和靶向代谢组学显示DT-109抑制胆汁酸代谢
6、DT-109改变与石胆酸相关的肠道微生物群
为了探索DT-109调控LCA代谢的潜在机制,对肝脏和粪便样本进行了非靶向和靶向代谢组学,并结合了宏基因组学。肝脏的靶向代谢组学显示,DT-109组和对照组猴肝脏中,total BAs (p = 0.0990)、 primary BAs (p = 0.0784)和secondary BAs (p = 0.0952)以及LCA (p = 0.0952)无显著差异。因此,接下来分析了粪便样本中的BA,结果显示DT-109组和对照组有明显分离(图6A-6C)。LCA在粪便样本中浓度最高,并且在DT-109处理后显著降低(图6D)。考虑到肠道细菌通过其前体CDCA的7α-去羟基化在产生LCA中发挥的关键作用,接下来使用16S核糖体RNA (rRNA)测序评估了DT-109对肠道微生物组的影响。
DT-109组和对照组猴子的粪便中微生物组成不同(图6E),在门和纲水平没有显著差异,但主要在属水平发现显著差异(图6F、6G)。为了鉴定与NASH严重程度和LCA代谢相关的细菌,我们接下来评估了细菌丰度与LCA代谢、NASH相关指数和肝脏LCA浓度之间的关系(图6H)。其他研究中曾报道Escherichia Shigella与血清AST、NAS、纤维化评分以及肝LCA呈显著的正相关;Faecalibacterium以其抗炎特性和降低小鼠肝脂肪变性的能力而闻名,并与血清AST、NAS、纤维化评分和肝LCA呈显著的负相关。
这些结果表明,NASH期间使用DT-109治疗可调节与LCA代谢和NASH严重程度相关的肠道微生物群。
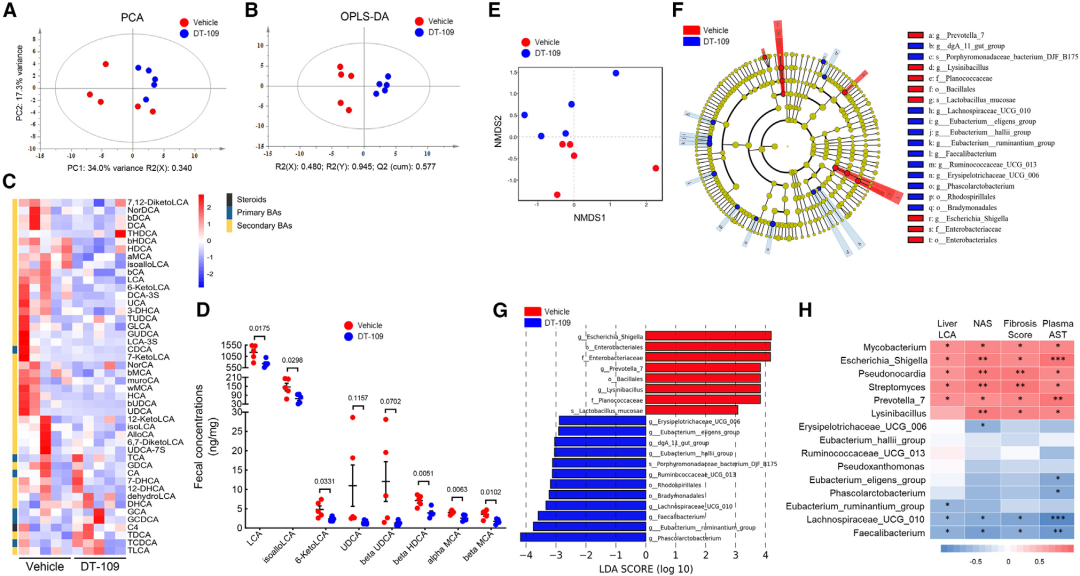
图6 非靶向和靶向代谢组学显示DT-109抑制胆汁酸代谢
7、DT-109抑制微生物产生石胆酸
接下来,通过研究确定DT-109是否通过调节肠道微生物群来抑制LCA的产生。qPCR分析,显示DT-109组粪便样本中Faecalibacterium prausnitzii,显著增加(图7A),而Escherichia Shigella显著减少(图7B)。接下来,使用同位素标记的CDCA (LCA的前体)来评估DT-109对微生物产生LCA的影响。将粪便样本与d4-CDCA孵育,在小鼠粪便提取物(FEs)中,DT-109处理剂量依赖性地减少了LCA的形成(图7C)。
为验证DT-109增加了普拉梭菌(Faecalibacterium prausnitzii)对LCA产生的抑制作用,将小鼠粪便样本与d4-CDCA孵育,实验组添加普拉梭菌,对照组加等量的培养基,并监测新生成的d4-LCA 持续24小时,普拉梭菌(Faecalibacterium prausnitzii)从孵育4 h开始显著减少了LCA的形成(图7D)。
最后,为了确定降低LCA的临床相关性,我们应用靶向代谢组学测量了NAFLD患者(n = 149)和健康对照者(n = 229)的LCA。校正年龄和性别后,循环LCA与NAFLD风险呈正相关(模型1);进一步校正甘油三酯后,LCA升高是NAFLD的独立预测因素(模型2);再进一步校正空腹血糖和高密度脂蛋白胆固醇后,关联仍然显著(模型3)。 综合结果表明,DT-109通过调节肠道菌群来增强普拉梭菌(Faecalibacterium prausnitzii),从而抑制LCA的产生。LCA是一种肝毒性BA,在NAFLD患者中增加,并与NAFLD的风险独立相关。
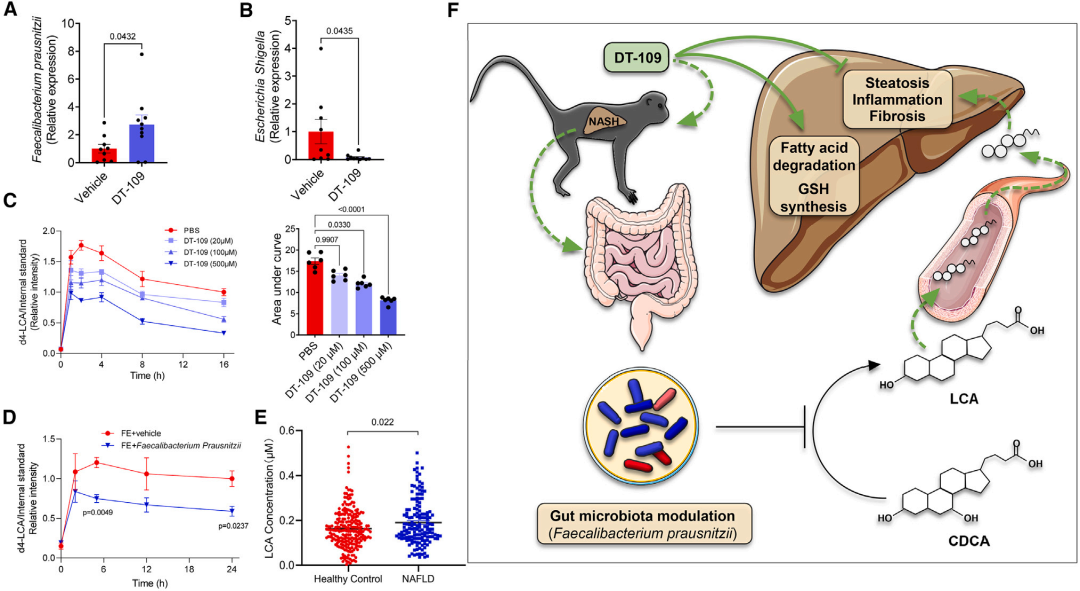
图7 DT-109抑制微生物产生石胆酸
三、研究结论
DT-109 (Gly-Gly-Leu)可剂量依赖性地减轻小鼠的脂肪性肝炎和纤维化。为了提高应用性,本研究开发了一个模拟人类NASH的非人灵长类动物模型。应用转录组学、蛋白质组学、代谢组学和宏基因组学相结合的多组学方法,发现DT-109不仅通过刺激脂肪酸降解和谷胱甘肽形成,而且通过调节微生物胆汁酸代谢,逆转了非人灵长类动物的肝脂肪变性并阻止了纤维化进展。研究描述了一个非人灵长类动物NASH模型,并强调了对DT-109进行临床评估的必要性。
参考文献:
DT-109 ameliorates nonalcoholic steatohepatitis in nonhuman primates.[J]Cell Metabolism, 2023.







