2022年发表于《Nature Communications》(IF =17.7)
一、研究背景
急性肾损伤(AKI)是一种常见的临床综合征,表现为肾功能突然下降,持续数小时或数天,导致废物积累,损害肾脏和身体其他部位。目前,AKI患者只能通过支持疗法进行治疗,尚缺乏减少组织损伤或促进修复的有效疗法。众所周知,肾小管上皮细胞(TECs)最容易受到AKI的影响。在轻度损伤后,成熟存活的TECs可以启动适应性修复过程,经历去分化、增殖和随后的再分化,以补充丢失的上皮细胞。相反,TECs在严重损伤后往往会发生不良反应,导致慢性损伤和纤维化表型。
表征AKI后的染色质动力学和分析TF调节网络可能阐明细胞对不同程度损伤反应的表观遗传学基础,从而确定适应性和非适应性肾脏修复的关键调节因子。在本研究中,分析了不同严重程度AKI后,小鼠肾TECs中染色质可及性和基因表达的动态变化,并构建和区分了TF调控网络。发现核受体RXRα是一个主要的TF,它决定了轻度或重度AKI的差异染色质状态和基因表达,RXRα的激活可以保护TECs免受严重AKI的影响。
二、研究结果
1、AKI后TECs的染色质动力学研究
为了探索AKI后适应性修复和非适应性修复期间全基因组染色质的变化,使用ATAC-seq检测假手术组、轻度肾损伤组(MI)TECs的染色质可及性动态变化(图1a和2a),得到四组差异染色质可及性区域(DARs)(图1b)。大多数DARs位于启动子和远端调控区(图1c),GO分析显示一些元件调控的基因促进了受损TECs的恢复(图1d)。图1e展示了轻度肾损伤(MI)后有代表性的差异染色质可及性区域(DARs)的变化情况。接下来,严重肾损伤(SI)TECs中的DARs进行了相同的分析,得到了类似结果(图2)。
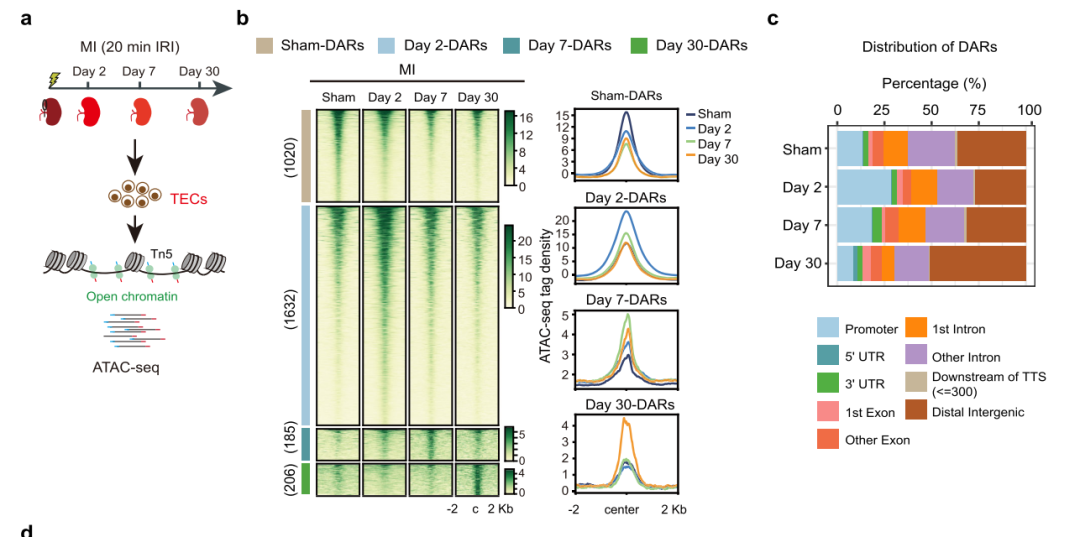
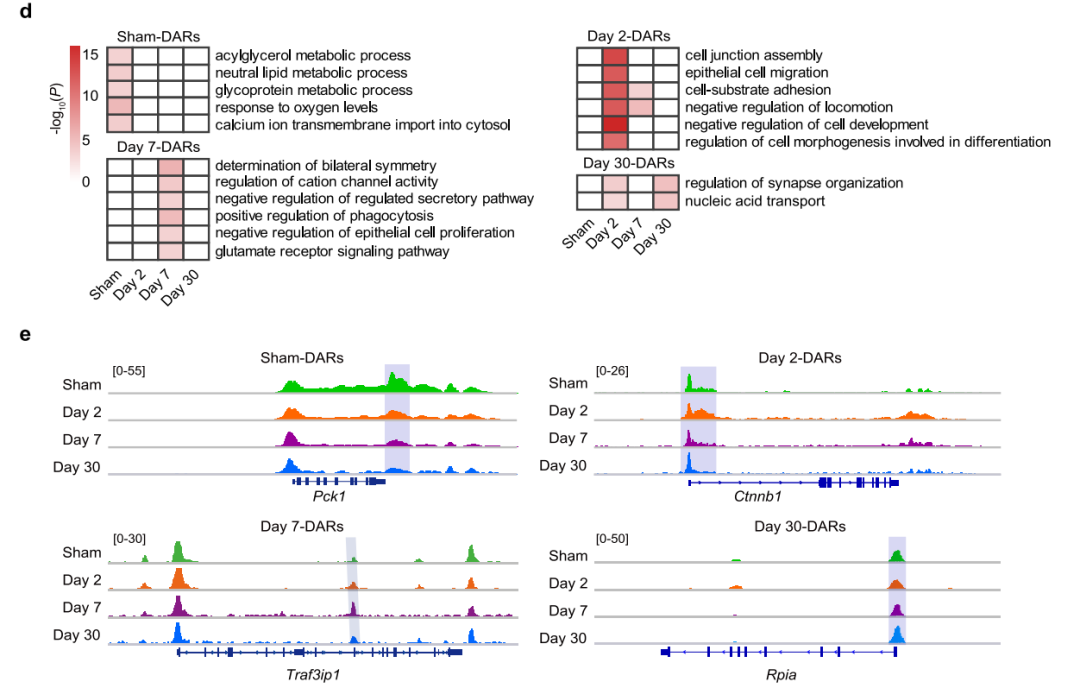
图1 轻度肾损伤后TECs的染色质可及性图谱
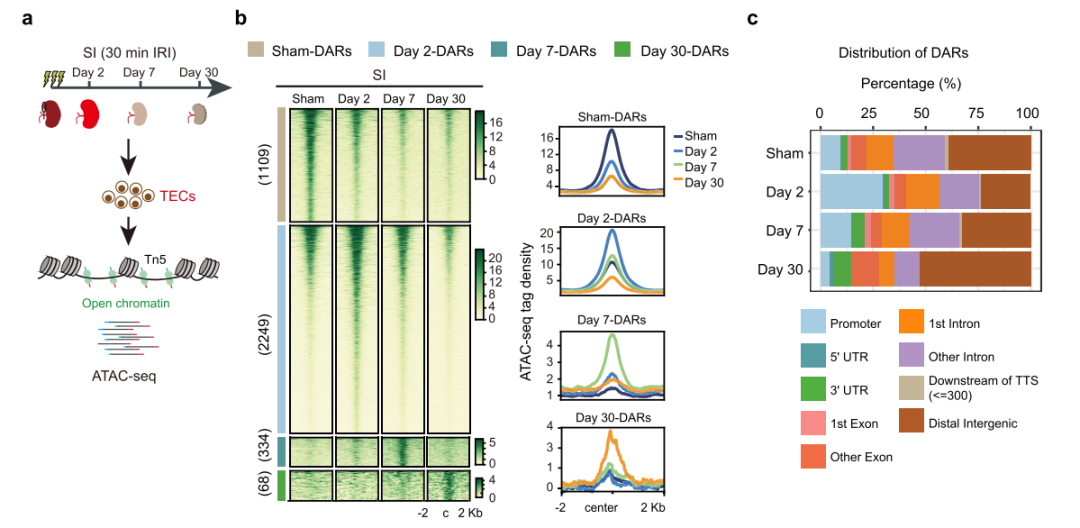
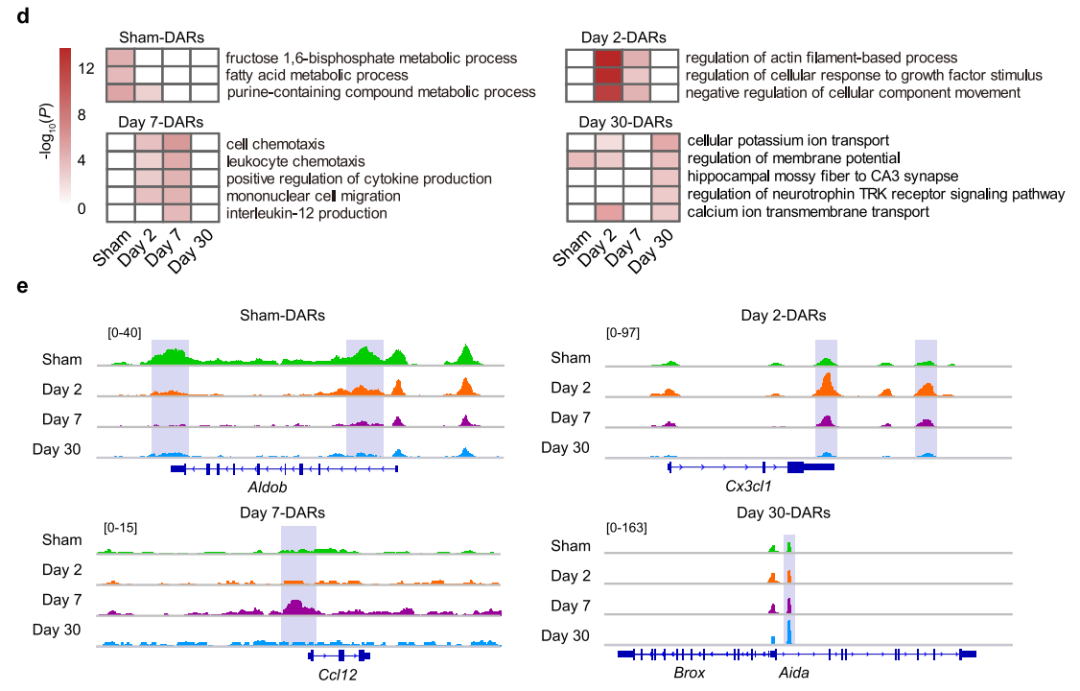
图2 严重肾损伤后TECs的染色质可及性图谱
2、损伤特异性染色质开放先于基因激活
为了区分适应性修复和非适应性修复的染色质变化,在轻度肾损伤(MI)和严重肾损伤(SI)后的第2天和第7天对TECs进行了ATAC-seq测序。结果表明,第2天和第7天,MI TECs和SI TECs表现出不同的染色质可及性图谱,在第2天,MI和SI之间开放染色质结构域的明显差异就出现了(图3a)。在第2天和第7天对AKI模型的TECs以及假手术小鼠的TECs进行RNA测序(RNA-seq)。数据表明,与染色质开放度的快速变化相反,基因表达的改变明显延迟。同时,对ATAC-seq和RNA-seq数据的综合分析显示,AKI后第2天,MI TECs和SI TECs之间染色质可及性的差异与基因表达变化的相关性较弱(P = 3.08×10-3)(图3c)。相比之下,在损伤后第7天,染色质可及性的变化与基因表达的变化有很强的相关性(P =2.20×10−16),H3K27ac ChIP-seq分析结果与基因表达一致,MI-DARs和SI-DARs中H3K27ac差异峰信号在第7天高于第2天(图3d)。通路分析显示,SI TECs中染色质可及性和基因表达较低的区域富集了肾功能基因,(图3g, h),表明SI TECs处于功能失调状态,这意味着SI TECs具有更高的纤维化和炎症潜能。
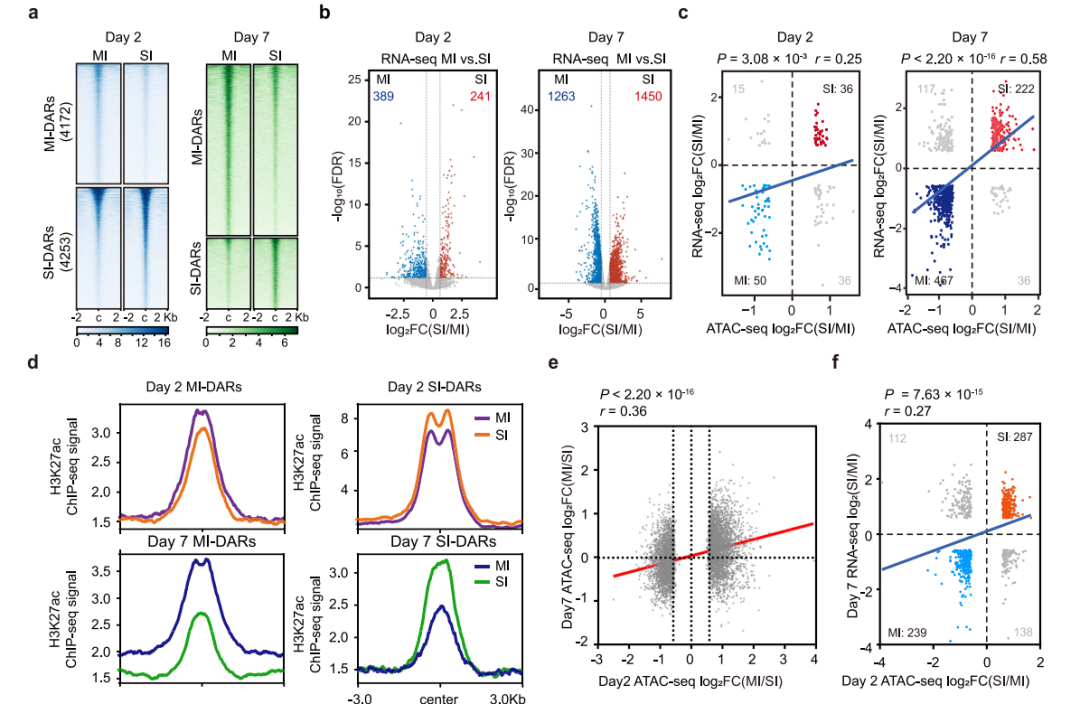
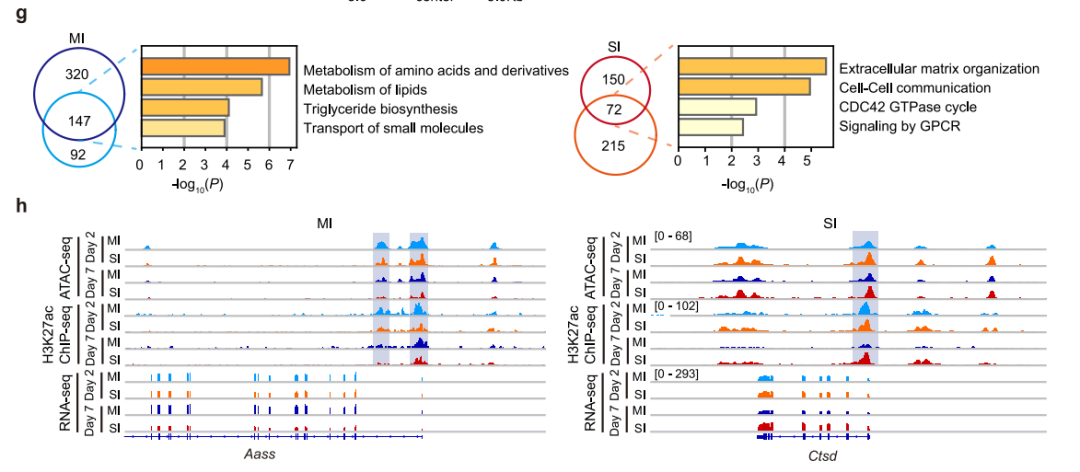
图3 损伤特异性染色质的开放介导基因激活
3、在适应性修复过程中,DARs富含RXRα motifs
开放的染色质结构域在很大程度上是由TFs建立和维持的,以控制基因表达。为了确定在不同肾损伤反应中负责调节染色质状态动态的关键TFs,分析了MI-DARs和SI-DARs上的TFs motifs。绘制了损伤后第2天和第7天MI-DARs和SI-DARs的TF调节网络。发现HNF4α、PPARα和RXRα是调MI-DARs染色质结构的核心TFs(图4d),而FOSL2和MEF2A是SI-DARs中富集的关键TFs(图4e)。该发现与HNF4α和PPARα之前的报道一致,说明了网络分析识别潜在参与损伤反应的TFs的可行性。在轻度肾损伤(MI)后的TECs中,RXRα是网络中富集最显著的TF,并对其进一步分析(图4d)。
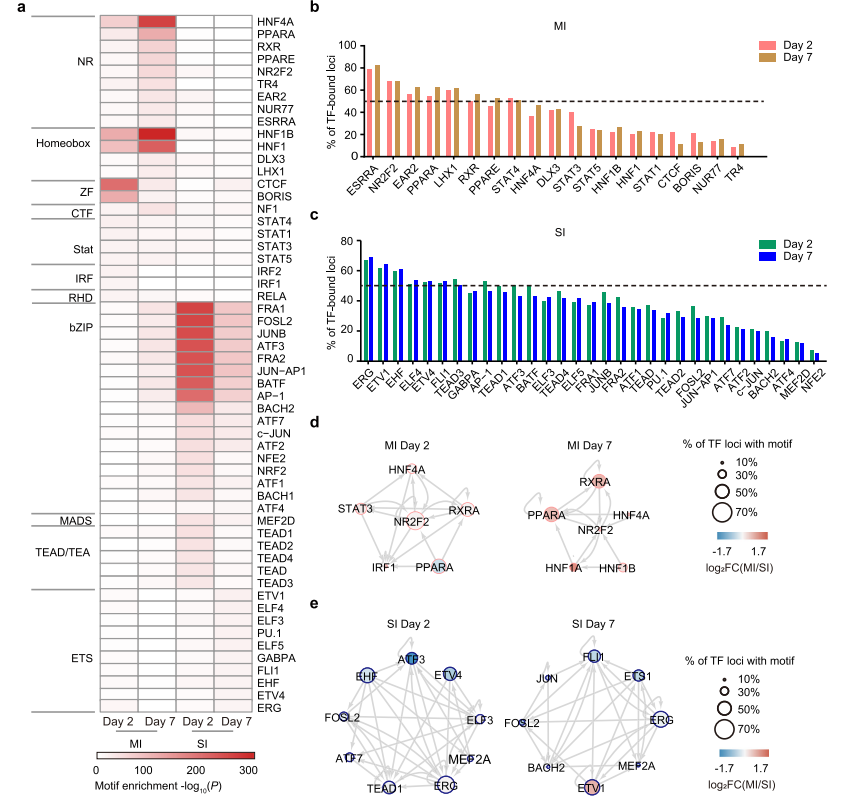
图4 适应性和非适应性修复中的转录因子调控网络
4、RXRα结合与染色质开放和基因表达相关
MI-DARs的ChIP-seq分析结果显示,约25%的MI-DARs中检测到RXRα结合(图5a)。将MI-DARs分为两组RXRα结合区和RXRα未结合区,并对RXRα 的ChIP-seq和ATAC-seq进行了整合分析,表明RXRα结合与染色质开放度呈正相关(图5c)。在与MI-DARs相关的基因中,RXRα结合基因的mRNA水平显著高于RXRα未结合基因(P = 1.76×10−13)(图5d)。总之,这些结果表明RXRα结合与轻度肾损伤(MI)后TECs的染色质开放和基因激活呈正相关。与轻度肾损伤(MI)组和假手术组相比,重肾损伤(SI)组TECs中RXRα mRNA和蛋白表达均下降(图5e、f),与此同时,SI TECs中MI-DARs中的RXRα结合和染色质可及性均显著降低(图5g)。
为了进一步探讨RXRα结合减少对SI TECs基因表达的影响,比较了这些RXRα结合基因和MI- DARs相关基因在MI和SI TECs中的基因表达。319个RXRα靶基因进行GO分析,发现与多种代谢过程和离子运输相关的途径富集(图5h),这对肾功能和修复恢复至关重要,将这319个基因定义为RXRα活化基因。
为了进一步探讨RXRα结合减少对SI TECs基因表达的影响,比较了这些RXRα结合基因和MI- DARs相关基因在MI和SI TECs中的基因表达。319个RXRα靶基因进行GO分析,发现与多种代谢过程和离子运输相关的途径富集(图5h),这对肾功能和修复恢复至关重要,将这319个基因定义为RXRα活化基因。
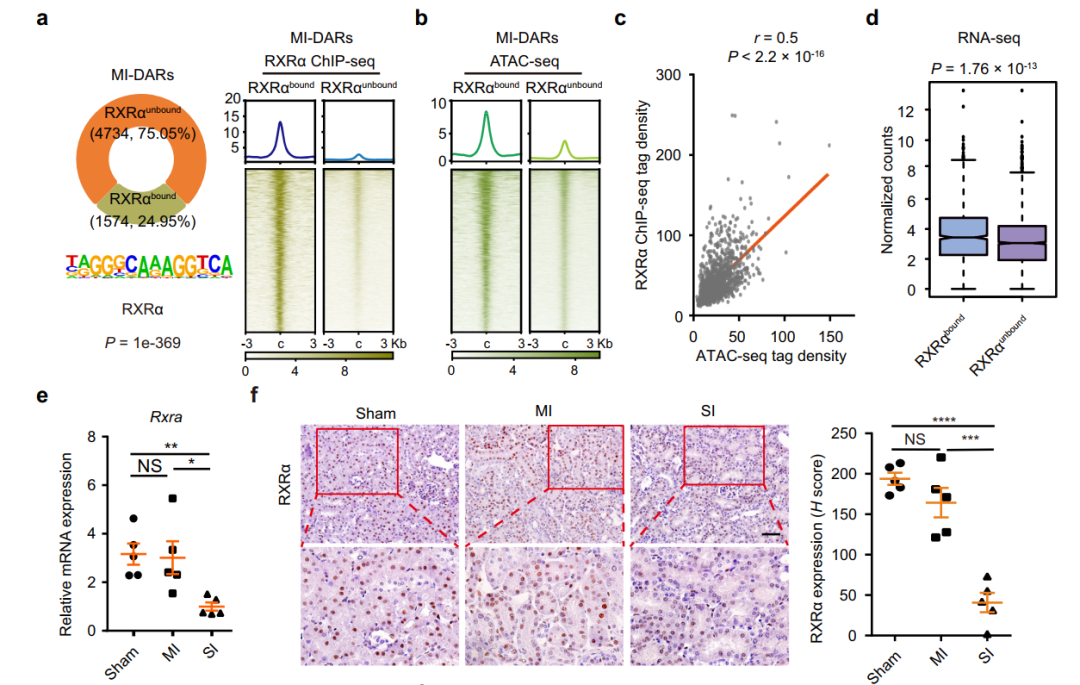
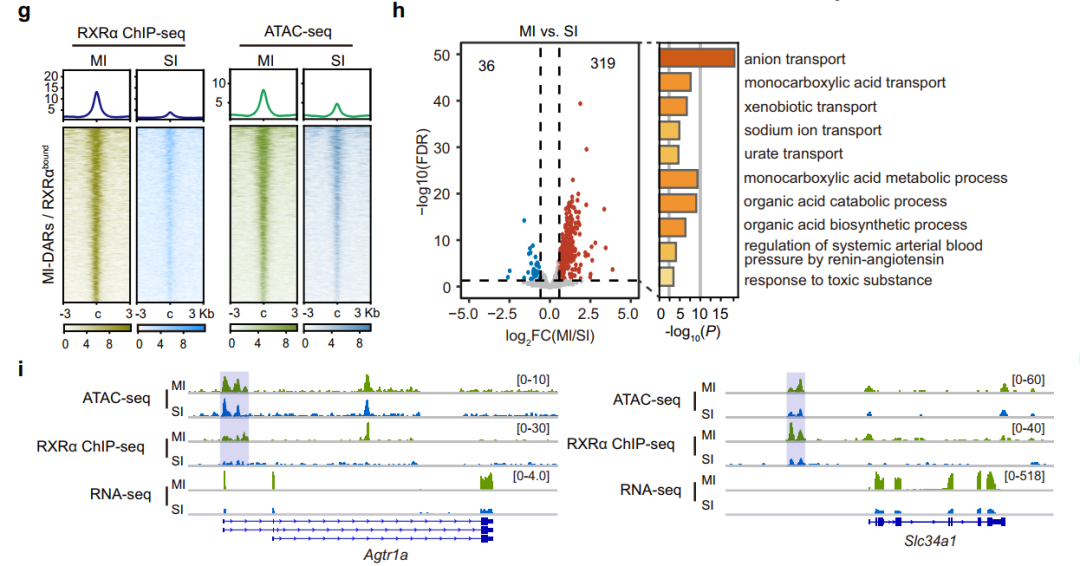
图5 RXRα的结合与染色质开放和基因表达相关
5、激活RXRα可保护严重肾损伤(SI)后的TECs
为进一步研究,激活RXRα是否可以促进肾修复并改善严重肾损伤(SI)后肾纤维化,对SI小鼠进行了Bexarotene (Bex,选择性激活RXRα的药物)处理。Bex给药大大降低了SI小鼠的死亡率,SI后第7天存活率从41.66%左右增加到100%(图6a)。Bex治疗还减少了SI后第2天的肾小管损伤(图6b)和血清肌酐水平(图6c)。到第30天,观察到Bex治疗小鼠的BUN水平大幅下降(图6d),表明肾功能得到改善。Col3a1和Fn1 mRNA水平的测定(图6e),马松染色和α-SMA阳性区域的定量来评估肾纤维化,显示Bex治疗后肾脏纤维化明显减少(图6f)。上述结果表明,RXRα的激活可以保护TECs免受严重肾损伤。
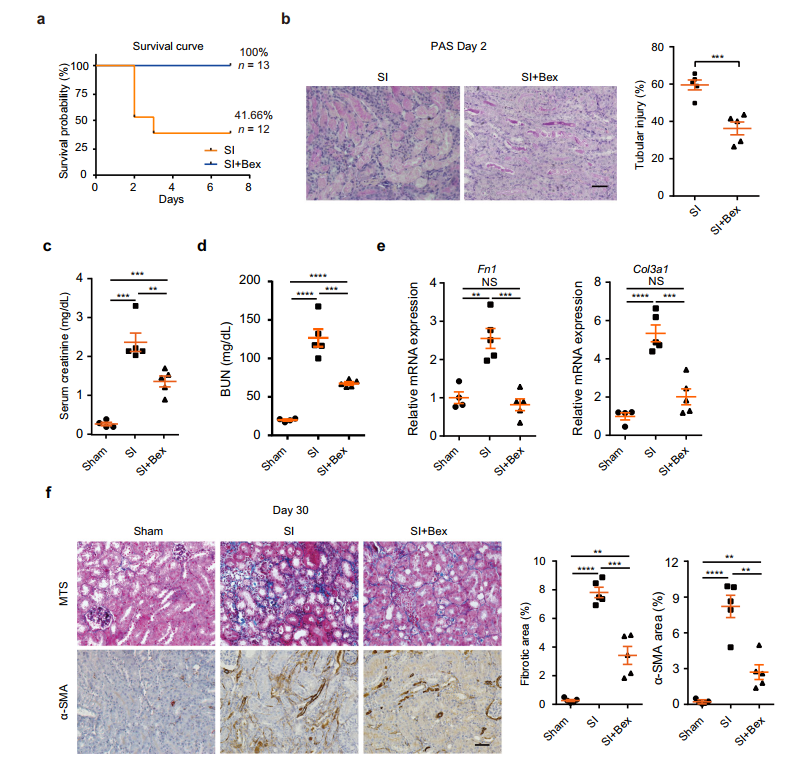
图6 Bex治疗保护TECs免受严重伤害
6、Bex可以恢复严重肾损伤(SI)后的染色质状态和基因表达程序
为了阐明严重肾损伤(SI)后Bex介导的肾保护的分子机制,分析了在轻度肾损伤(MI)和SI后第7天RXRα结合、染色质可及性和基因表达情况。经Bex处理后,SI小鼠MIDARs中RXRα的基因组占用率显著增加,将RXRα结合恢复到与MI小鼠相当的水平(图7a)。ATAC-seq分析显示,经过Bex处理后,SI小鼠MIDARs中染色质可及性发生了重编程(图7b)。RXRα在MIDARs上结合的增加与Bex处理后SI小鼠染色质可及性的增加呈正相关(图7c)。重要的是,Bex处理诱导了RXRα活化基因的显著上调(图7d,e)。
综上所述,这些发现表明,Bex治疗通过增加RXRα的募集和RXRα相关的染色质重塑来激活基因,从而保护SI小鼠的TECs免受急性损伤。
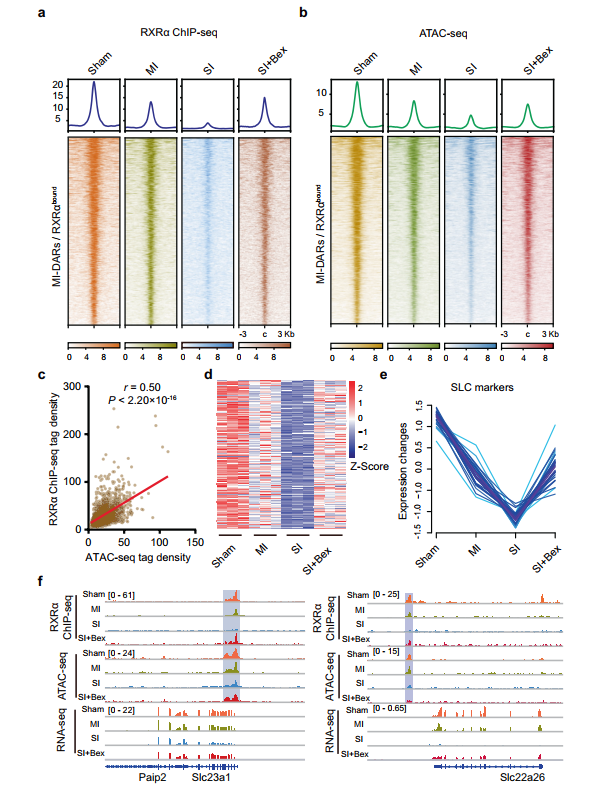
图7 RXRα的激活可重编程染色质状态和基因表达
7、RXRα表达与AKI患者疾病严重程度相关
利用小鼠和人AKI的scRNA-seq数据集,评估了PTC亚群中RXRα和RXRα活化基因的表达。RXRα和RXRα活化基因的表达随着损伤程度的加重而降低(图8a-c)。肾损伤严重程度与RXRα或其靶基因的下调呈正相关(图8d, e)。
为进一步验证RXRα在AKI中的临床相关性,进行了临床验证(n = 28)。肾毒性10例,缺血性损伤7例,缺血性合并肾毒性损伤3例,其他3例,未知5例。AKI患者组织切片采用免疫组化染色法检测RXRα的表达,癌旁肾组织作为对照,RXRα在SI患者肾脏中的表达显著降低(图8f)。此外,RXRα在AKI 2期和3期患者中的表达低于AKI 1期患者,表明RXRα表达与AKI的临床严重程度呈负相关(图8g)。进一步分析显示,RXRα表达水平与Scr、BUN的含量呈负相关(图8h)。上述数据表明,严重AKI患者肾小管RXRα表达减少,与肾小管损伤和肾修复失败相关。

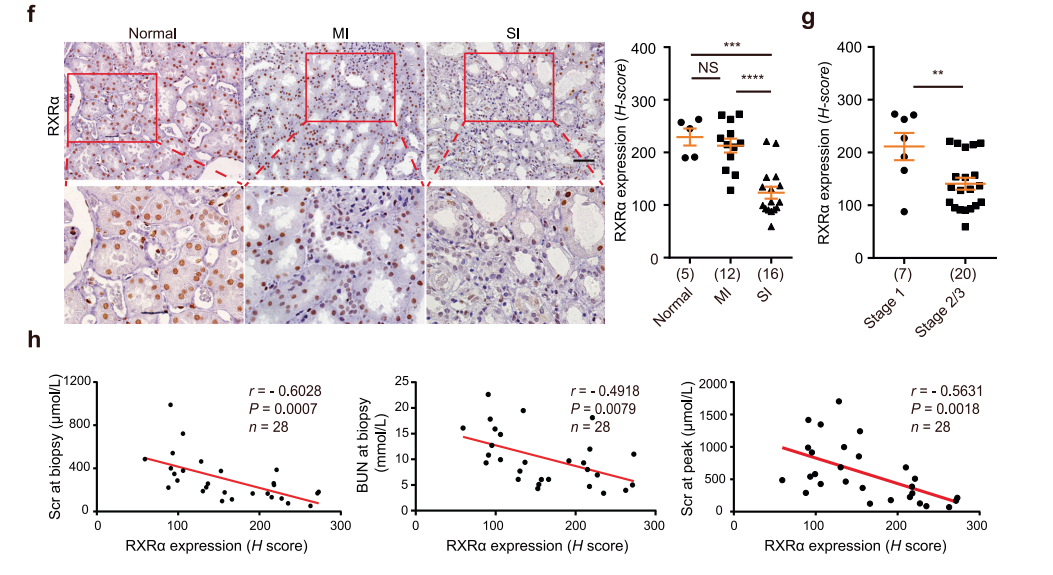
图8 AKI小鼠和患者中RXRα表达与肾疾病严重程度呈负相关
三、研究结论
RXRα是促进急性肾损伤(AKI)适应性修复的关键转录因子,Bex可以激活RXRα,恢复染色质状态和基因表达,保护TECs免受严重肾损伤。RXRα是急性肾损伤的潜在治疗靶点。
参考文献:
Chromatin accessibility dynamics dictate renal tubular epithelial cell response to injury.[J]Nature Communications, 2022.












