| 时间:2023-04-28 |
二、研究结果
1、PCa中调控元件的3D相互作用
在雄激素缺失的VCaP细胞中鉴定出74514个高信号H3K27ac环(FDR和lt; 0.05),发现DHT处理2 h和24 h后,环数分别下降到61748个和46819个(图1b)。与之形成鲜明对比的是,在雄激素缺失条件下,AR环的数量从9751个增加到DHT处理2 h和24 h后的24982个和24737个(图1b),说明激活的AR位点参与了3D染色质相互作用。总体而言,37.0%的H3K27ac锚点与50.1%的AR锚点重叠(图S1d),表明大多数H3K27ac环不依赖于AR。
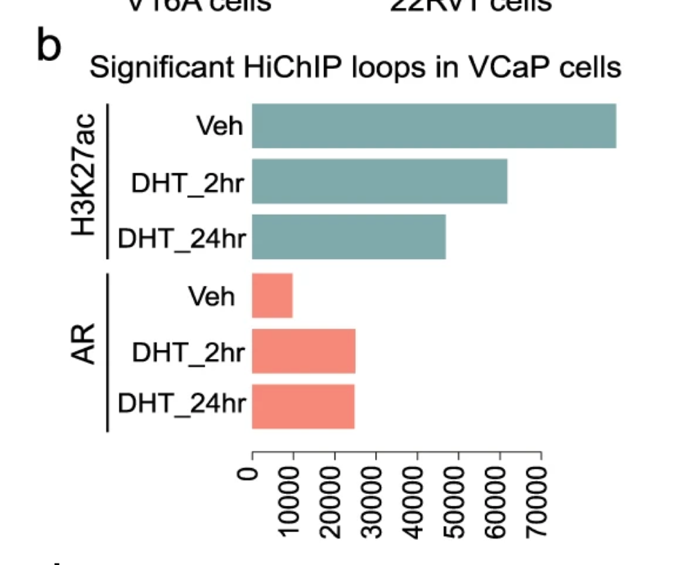
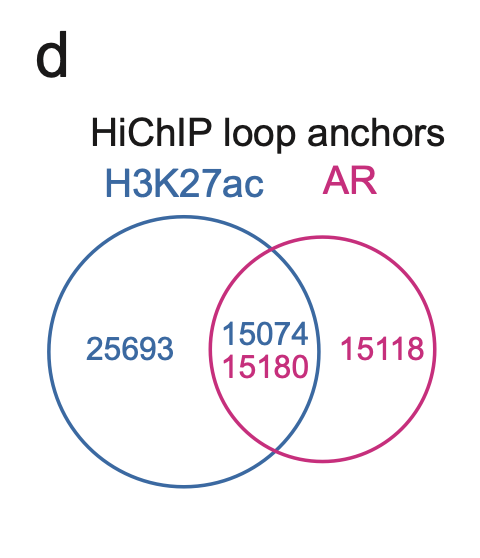
图1.PCa细胞系中调控元件相互作用
2、H3K27ac和AR环在雄激素诱导的基因调控中发挥不同的作用
在雄激素处理2小时和24小时后,H3K27ac环的数量分别出现中度和明显的减少,但具有更多reads的H3K27ac环的数量保持稳定;相反的是,AR环路数量是显著增加的。在差异表达的基因上,对于DHT上调的基因,DHT的处理2小时和24小时后,H3K27ac环强度没有明显的变化,而AR环显著增加;在下调基因中,H3K27ac环强度略有减弱,而AR环中的相互作用可忽略不计,说明AR在急性雄激素刺激中的直接功能是转录激活,而不是抑制。
在转录因子中,AR和FOXA1在DHT激活基因启动子的H3K27ac+/AR+环的远端锚点富集程度最高(图S2h)。CTCF和KLF4在DHT激活的基因启动子相关的远端H3K27ac+/AR+锚点和DHT抑制的基因启动子相关的远端H3K27ac锚点均显著富集,表明其在转录调控中具有普遍的功能(图S2h)。ERG、NFYA和ETV4与锚定在DHT抑制基因启动子上的H3K27ac环特异性相关(图S2h)。
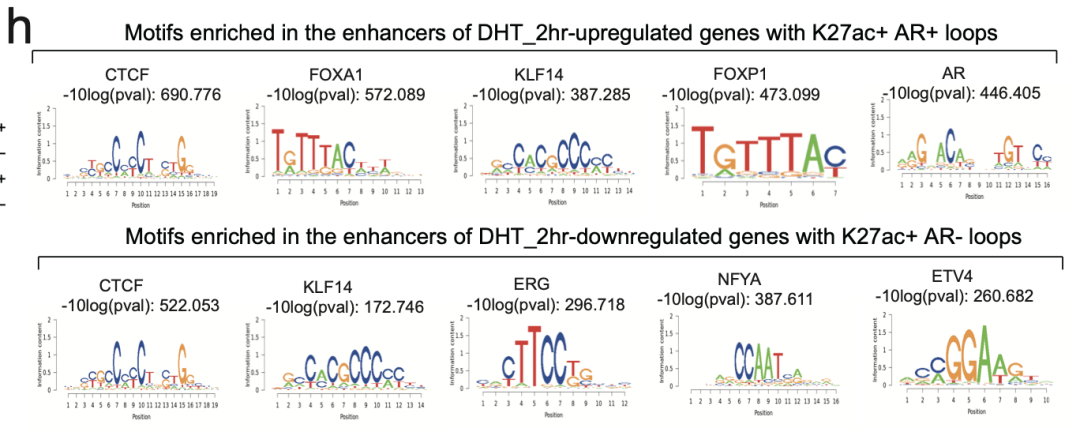
图S2. 在K27ac+ AR+环的DHT上调基因增强子中富集程度
3、细胞类型特异性的CTCF环调控PCa相关基因的表达
CTCF通过形成锚定在TAD边界的CTCF-CTCF环来隔离RE相互作用,也通过直接与活性REs结合来调节RE相互作用。与H3K27ac阴性(H3K27ac−/−)CTCF环相比,两个锚点H3K27ac双阳性(H3K27ac +/+)的CTCF环变化明显(图2f),提示H3K27ac +/+ CTCF环在促进基因转录中发挥作用。与H3K27ac−/−和+/+ CTCF环相比,H3K27ac -/+ CTCF环内基因的中间表达改变表明H3K27ac -/+ CTCF环具有转激活和绝缘功能(图2f)。
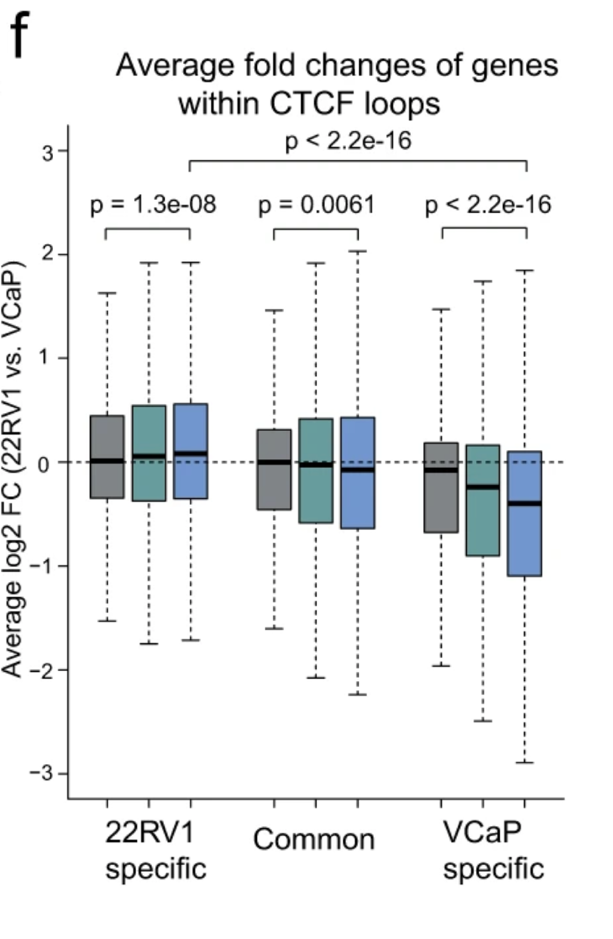
图2.细胞类型特异性CTCF环调节PCa相关基因
2、敲除MYC启动子附近的CTCF位点会导致CTCF循环发生巨大变化
为获得CTCF介导的CTCF结合位点与基本癌症基因之间接触的全局视图,作者们将DepMap20中检索的2134个癌症发展的必要基因分为H3K27ac阴性(H3K27ac-)和H3K27ac阳性(H3K27ac+)两组,在结合亲和力变化的研究中发现H3K27ac- CTCF位点更有可能是抑制其环状的必需基因。在对照组和−10Kb CTCF位点敲除(sgdel-10Kb) 22Rv1细胞生成了CTCF和H3K27ac HiChIP数据,表明“−10Kb CTCF位点”的敲除完全破坏了−10Kb CTCF位点和MYC增强子-对接位点之间的CTCF环路,并引入了大量新的h3k27ac相关环路,将多个上游增强子连接到MYC区域(图3b)。
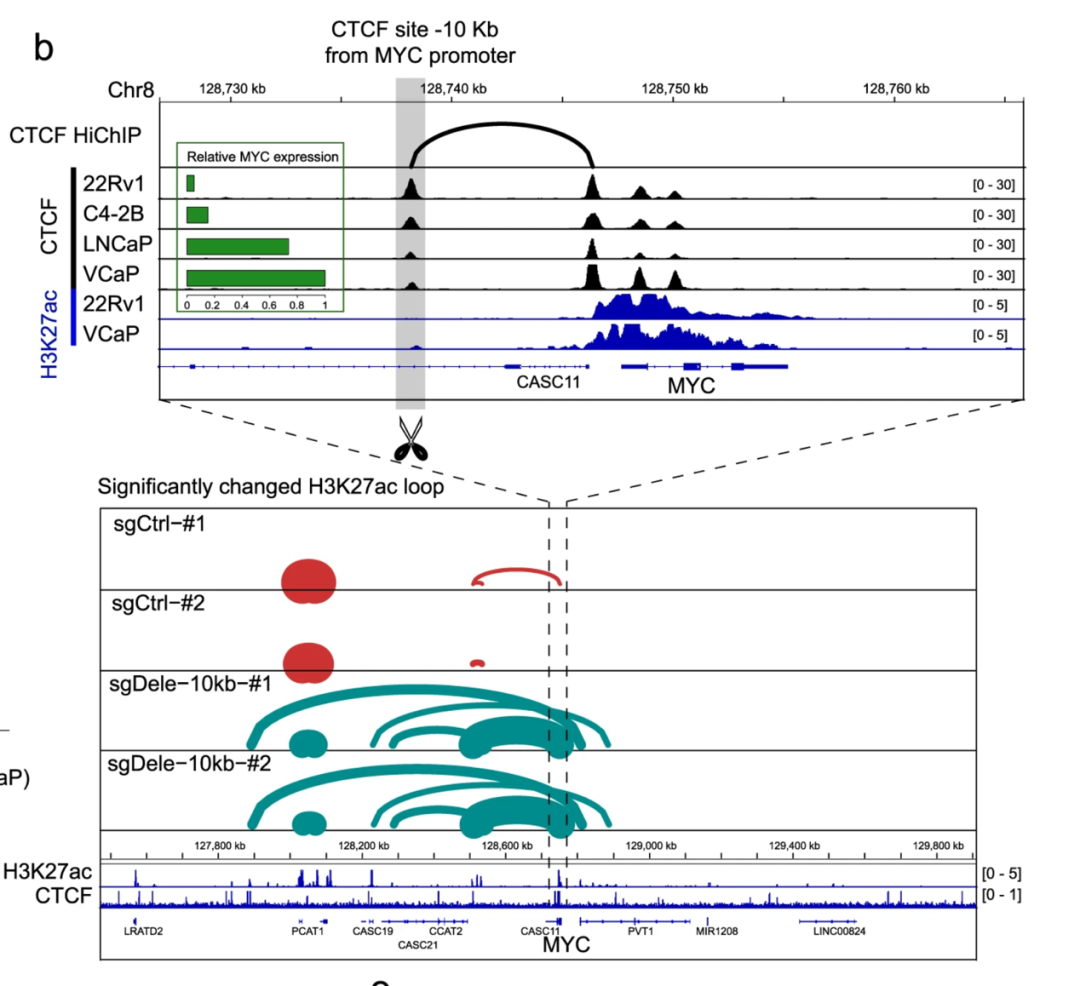
图3.敲除MYC启动子附近的CTCF位点导致CTCF环的变化
3、MYC在CTCF环锚中富集
通过−10Kb CTCF位点的敲除,发现−10Kb CTCF位点的抑制导致CTCF在该位点的结合减少,MYC表达、细胞增殖、MYC在靶基因上的结合亲和力和MYC靶基因表达增强。
4、MYC促进CTCF染色质结合
为了进一步评估MYC对CTCF介导的3D染色质组织的影响,在对照和MYC过表达的22Rv1细胞中进行了RNA-Seq、MYC/CTCF/H3K27ac ChIP-Seq和CTCF/H3K27ac HiChIP检测(图4a, 4b)。研究了MYC和CTCF蛋白之间是否存在物理相互作用。通过免疫共沉淀(co-IP),在对照组和MYC过表达的22Rv1细胞中观察到MYC和CTCF之间的相互作用(图4h)。MYC-CTCF相互作用通过GST-pulldown实验、标记蛋白co-IP实验和接近连接实验进一步证实(图4i-k)。表明MYC与CTCF相互作用,并促进其在CTCF/MYC共同位点的染色质占用。
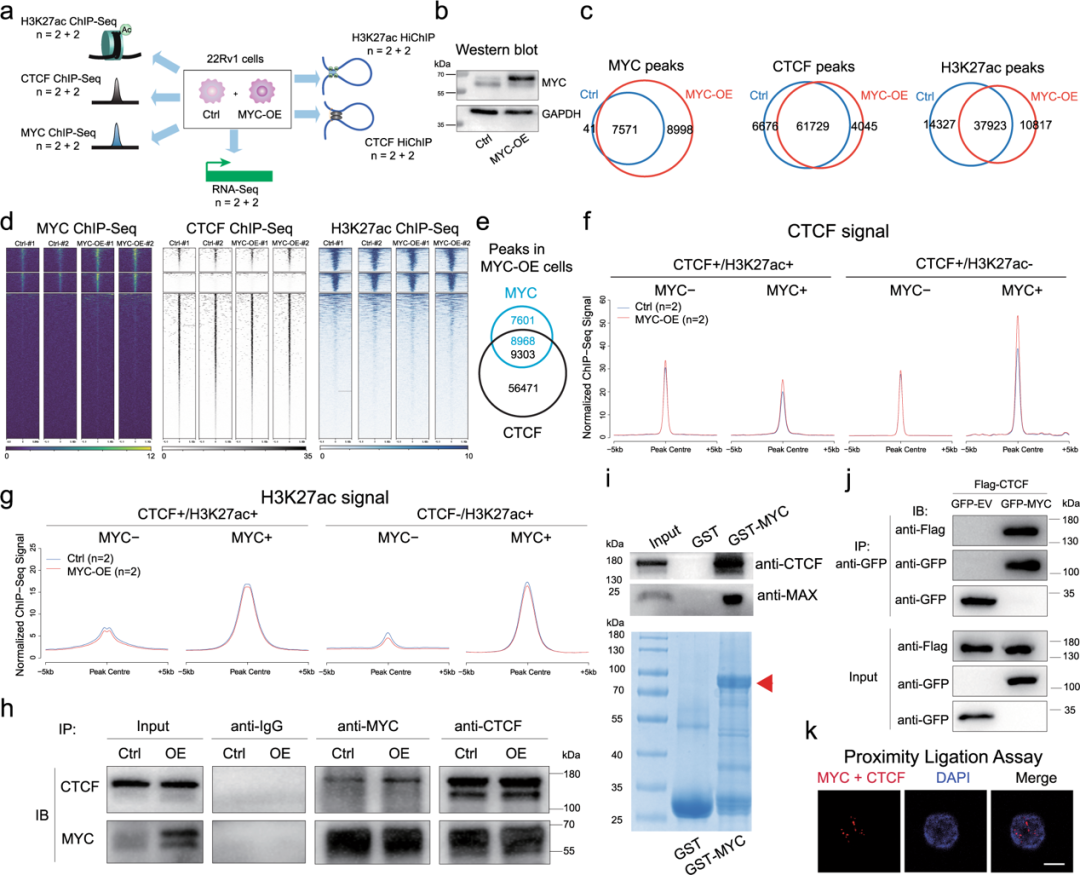
图4.MYC促进CTCF染色质结合
4、MYC通过增强CTCF介导的染色质环来抑制神经内分泌谱系可塑性基因
作者们研究了MYC对CTCF介导的环化和基因表达的影响,差异表达分析在MYC过表达时,DESeq2基因的抑制数量(n=479)高于激活基因(n=181)(图5a)。MYC激活的基因富集了细胞增殖基因集,而MYC抑制的基因富集了神经发生和内分泌相关基因集(图5b),基因集富集分析(GSEA)显示MYC显著下调泛NET基因(P = 5.19e-06;图5 c)。H3K27ac相关染色质环在MYC上调基因启动子处增强,而在MYC下调基因启动子处减弱(图5d),MYC表达对CTCF环的增强作用大于减弱作用(n=5609和n=2502)。CTCF向上和向下循环的分布曲线均在150~330 Kb处出现峰值(图5e)。增强的CTCF环有很大一部分跨越了TAD边界(图5f),表明它们具有远距离绝缘功能。在原发PCa和CRPC数据集中,高泛NET评分与低MYC活性显著相关(图5j),突出了MYC诱导的神经内分泌基因抑制的临床意义。这些数据表明MYC通过增强CTCF介导的染色质环来抑制神经内分泌基因的转录。
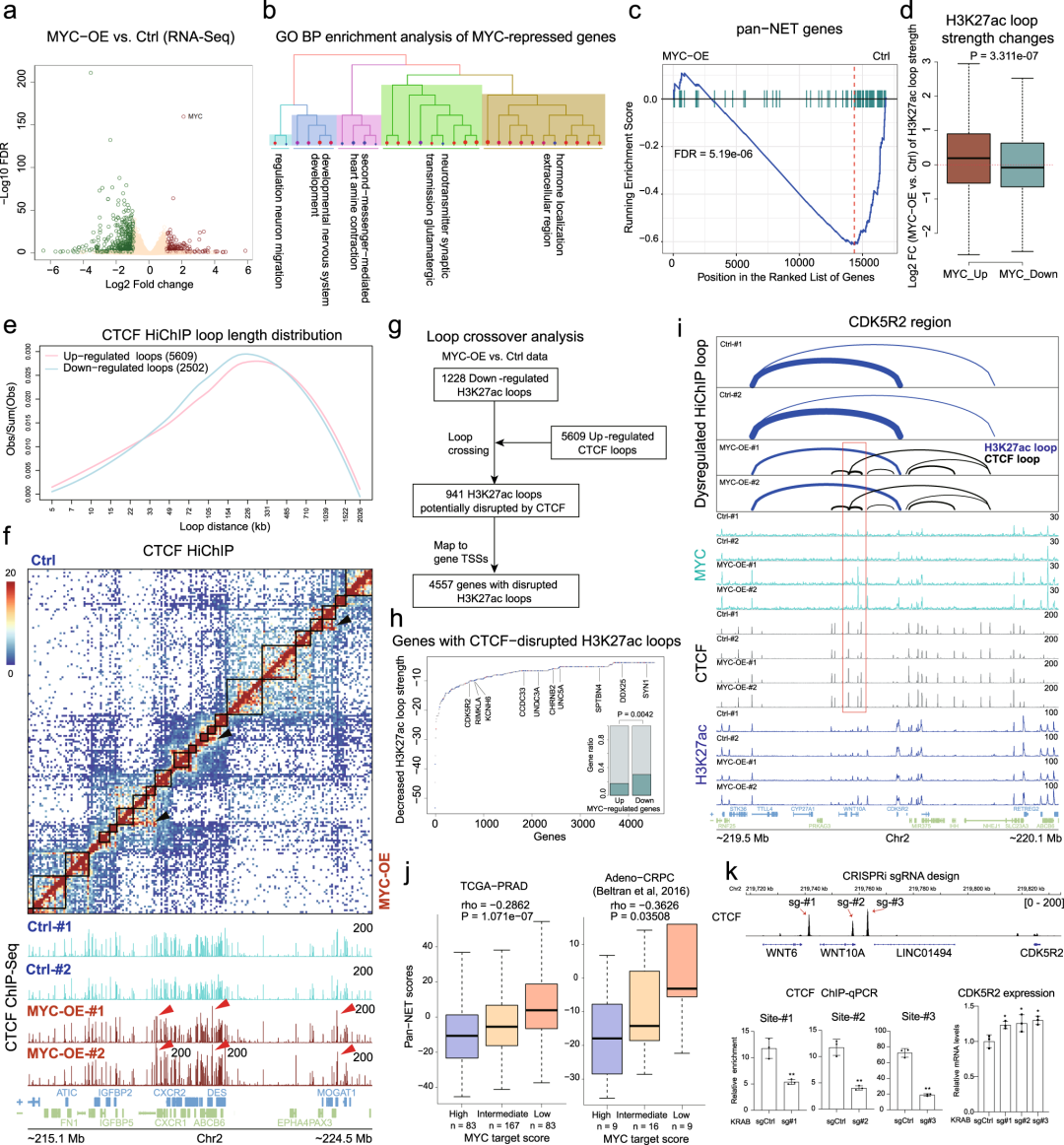
图5.MYC通过增强CTCF介导的染色质环来抑制神经内分泌基因
三、结论
本次研究发现基因启动子附近的几个CTCF位点抑制了PCa24中的基因表达,雄激素通过破坏PCAT1区域内的超级增强子和MYC启动子之间的相互作用来抑制MYC转录,并且MYC增强CTCF介导的染色质环,以抑制PCa中一个基因子集的表达。
参考文献:
Wei, Z., Wang, S., Xu, Y. et al. MYC reshapes CTCF-mediated chromatin architecture in prostate cancer. Nat Commun 14, 1787 (2023). https://doi.org/10.1038/s41467-023-37544-3