| 时间:2023-04-13 |
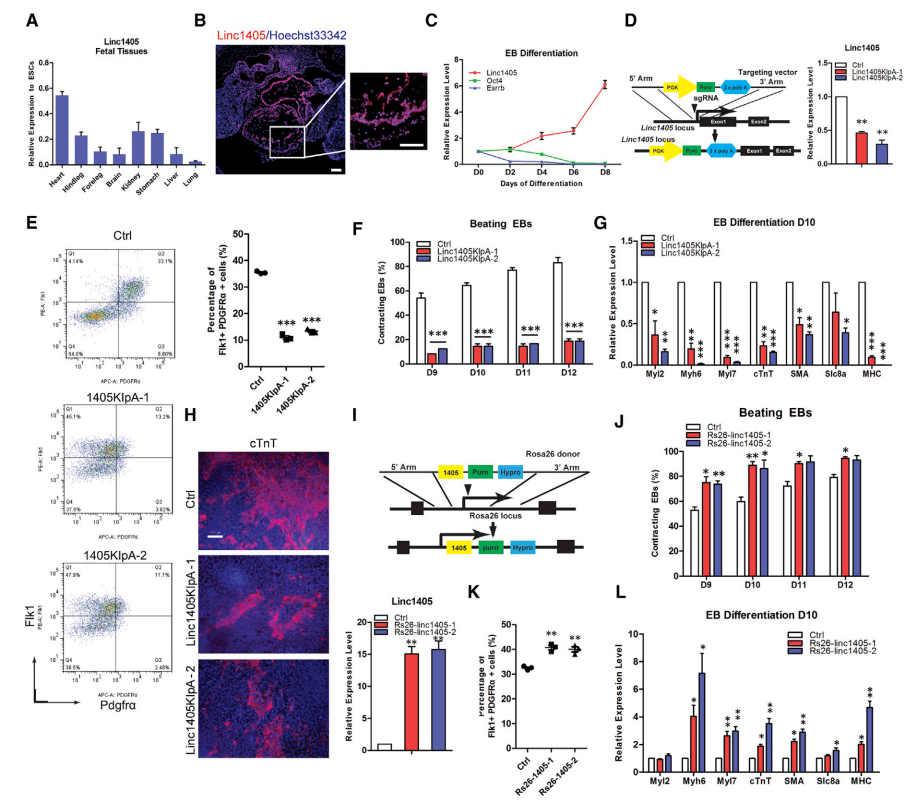
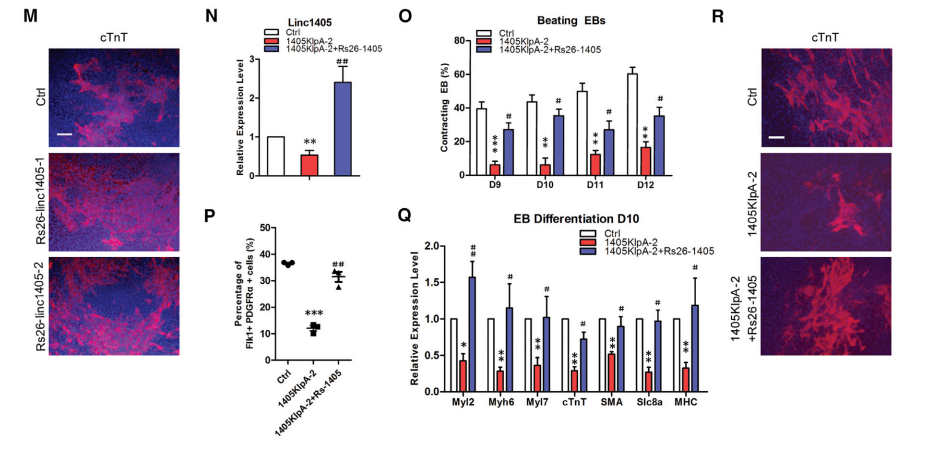
图1 Linc1405对心脏分化至关重要
2、Linc1405调节驱动心脏分化的核心基因网络
本研究重点探讨了linc1405决定中胚层细胞命运的分子机制。鉴定出在linc1405-敲低MES细胞中差异表达的65个上调基因和124个下调基因(图2A和2B)。上调的基因主要与骨骼发育和器官形态发生相关,基因的分子功能将其归类为转录因子。相应的,下调的基因主要被分类为转录因子和DNA 结合蛋白,主要与多细胞生物发育和细胞分化相关(图2C)。
GO分析显示,DEGs主要富集于模式形成过程、肌肉组织发育、心脏发育相关,肌肉结构成分、蛋白质结合、钙离子结合等通路(图2H)。linc1405可能是心脏中胚层特异性发育的重要调节因子,因为它的敲除会阻断心脏的命运决定。
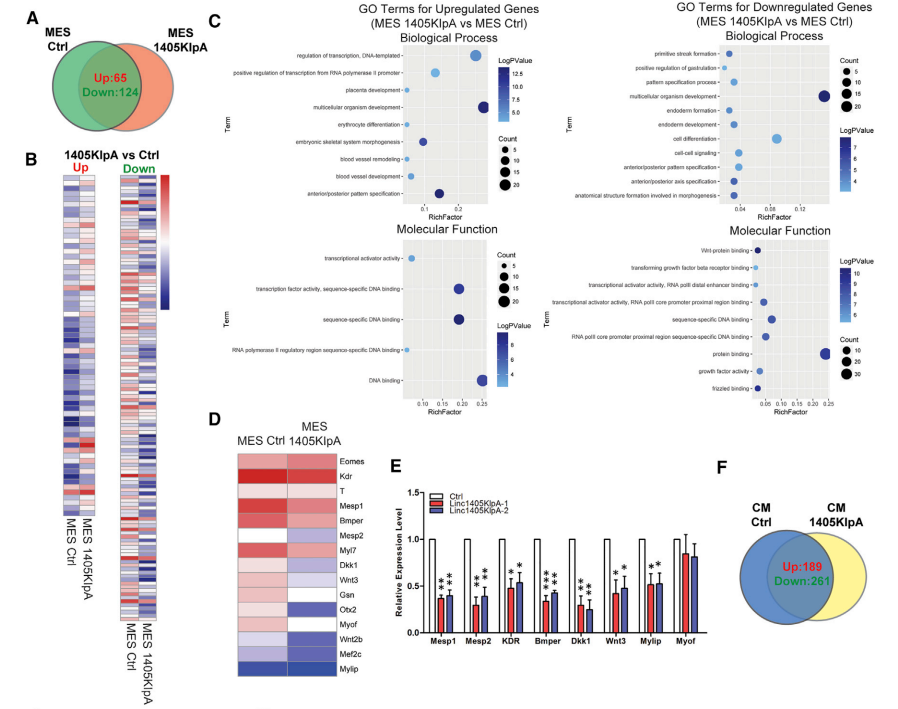
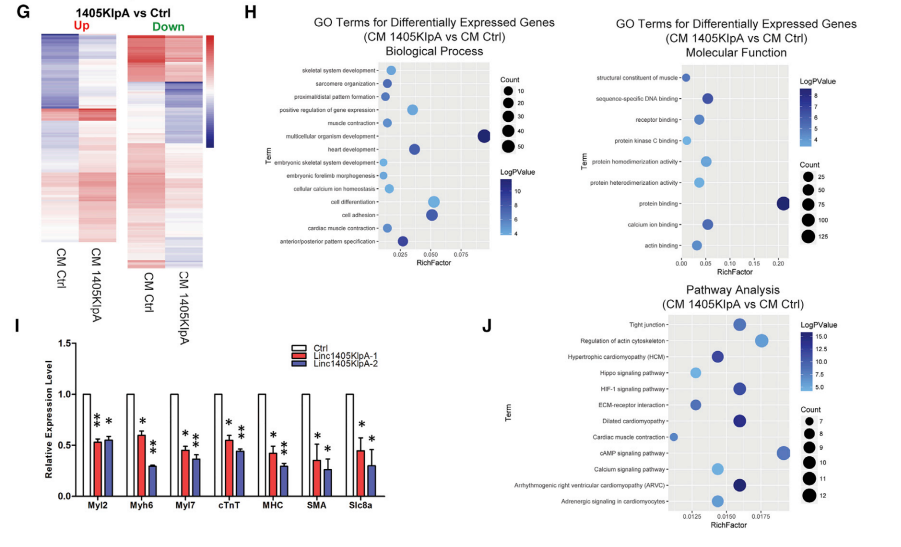
图2 Linc1405调节驱动心脏分化的核心基因网络
3、心脏中胚层发育过程中Linc1405与Eomes相互作用
通过RNA免疫沉淀(RIP)实验,证实了外源性和内源性Eomes都可以与linc1405结合(图3B和3C),并且表明linc1405与Eomes有特异性相互作用。Eomes的破坏导致心脏中胚层分化缺陷和原肠形成缺陷导致的胚胎致死。
通过建立敲除Eomes的ESCs(减少40%),Eomes的敲除显著降低了EB自发搏动的比例,降低了EB分化表达水平,降低了cTnT+ CM的比例(图3D-3G)。建立敲除Eomes、过表达linc1405的ESCs,与过表达linc1405的EBs相比,Eomes敲除后,跳动EBs的百分比、心脏标志物的表达水平和cTnT+细胞数量均显著降低(图3H-3J)。研究结果证实,Eomes是心脏分化的关键因素,linc1405/Eomes相互作用是linc1405在心脏谱系分化中的功能所必需的。
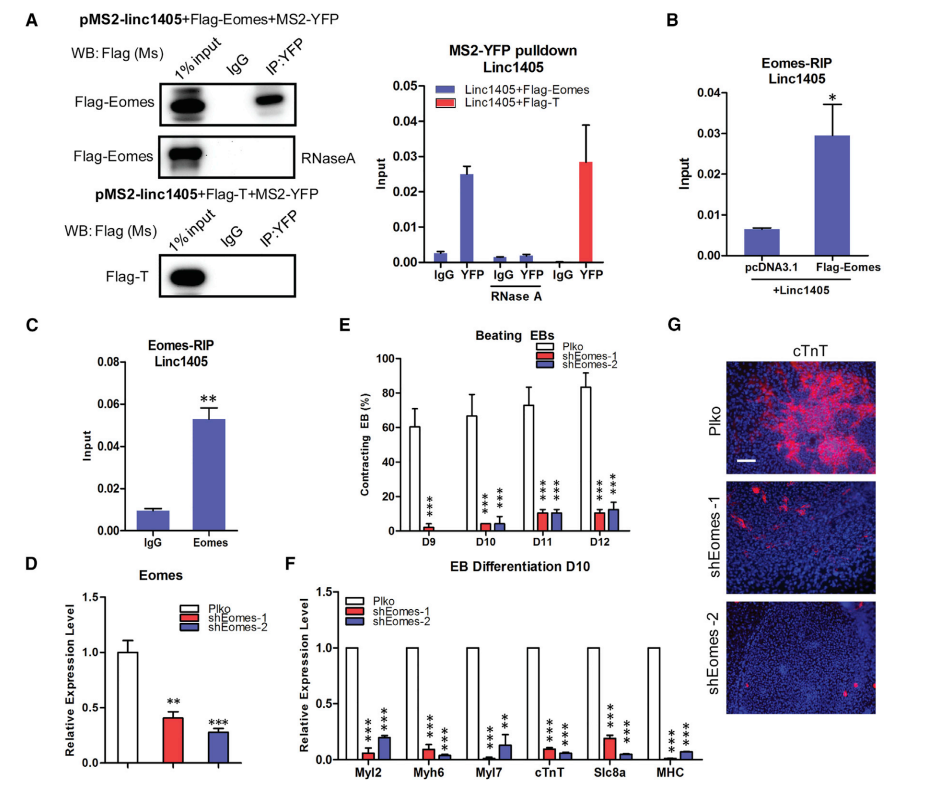
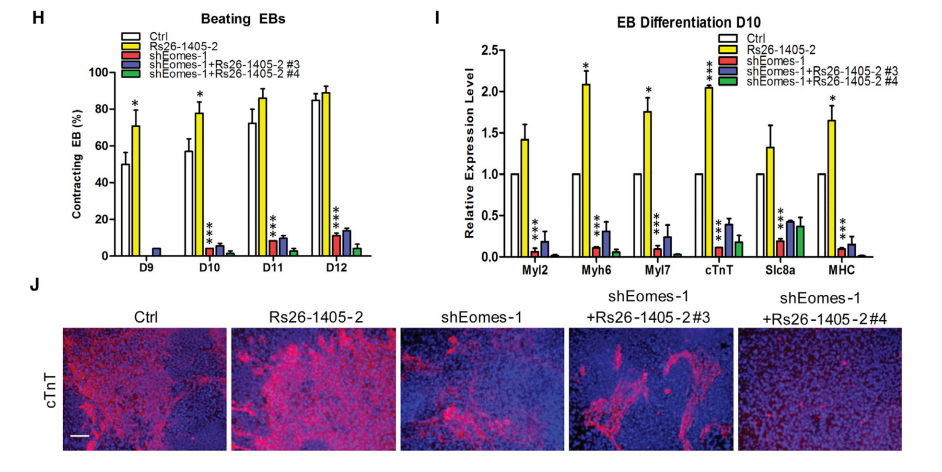
图3 心脏中胚层发育过程中Linc1405与Eomes相互作用
4、Linc1405的外显子2负责Eomes结合和心脏分化
Linc1405主要由两个外显子组成,RIP和RNA pull-down实验结果显示Eomes主要结合linc1405的外显子2,而不是外显子1(图4A、4B)。然后,将linc1405的每个外显子敲入46C ESCs的ROSA26位点,外显子2的引入促进了收缩EBs的百分比、心脏特异性基因的表达和cTnT+细胞的数量,而外显子1的引入没有显著影响(图4C-4E)。后续构建了linc1405外显子2双敲除ESCs (Exon2DKO),结果发现完全缺失linc1405外显子2显著抑制了ESCs的心脏分化,心脏标记物的表达受损,搏动EBs和cTnT+ CMs的百分比降低,Flk1+ Pdgfγα+中胚层细胞的百分比降低(图4I-4L)。综上所述,数据表明Eomes和Linc1405外显子2的相互作用是心脏分化的主导因素。
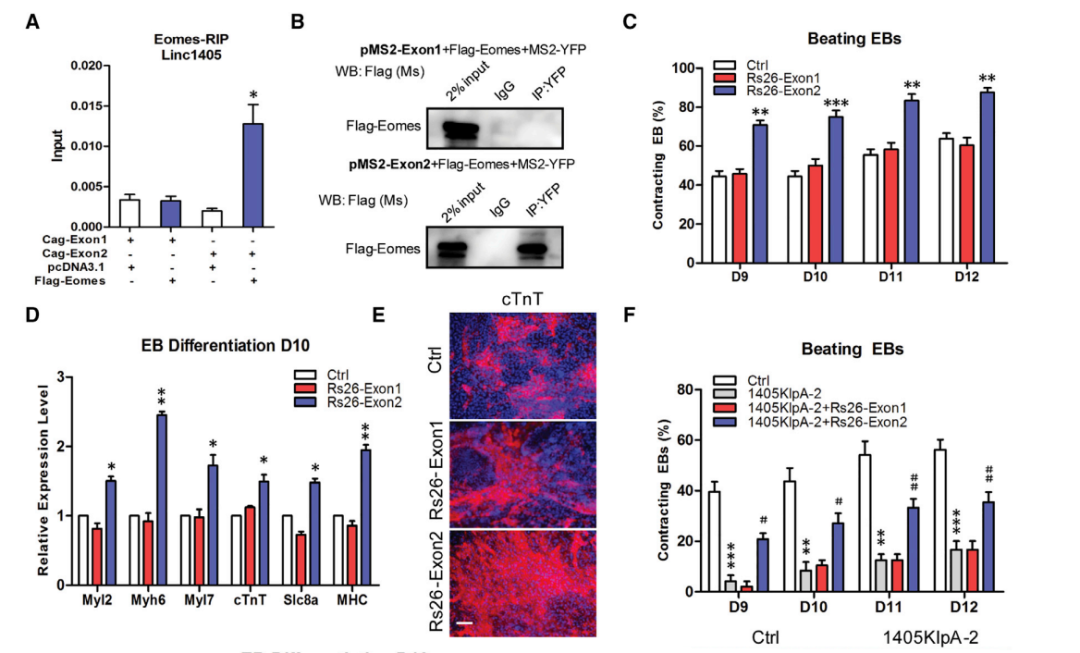
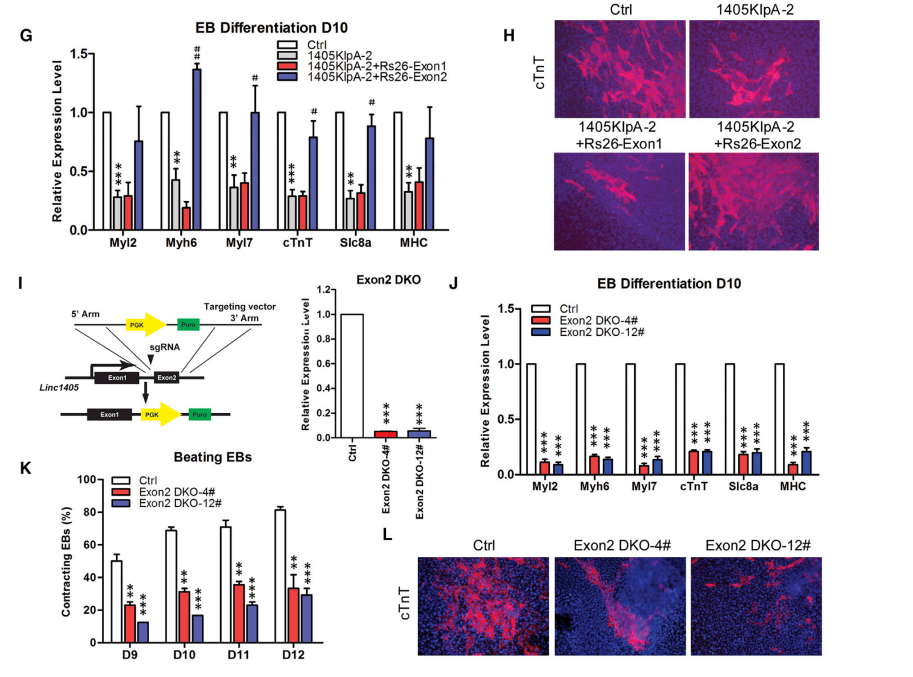
图4 linc1405的外显子2负责Eomes结合和心脏分化
5、Mesp1是Linc1405在心脏分化过程中的功能靶点
在心脏命运决定过程中,Mesp1是Eomes的关键下游靶点,并驱动心脏分化。在EB细胞分化过程中,敲低linc1405时,Mesp1的表达水平显著降低,而在linc1405过表达后,Mesp1的表达水平升高(图5A-5D)。外源性Mesp1的引入显著缓解了两株linc1405敲除的ESC细胞系中EBs的心跳百分比和cTnT+心脏细胞的数量(图5E、5F)。与linc1405基因下调细胞相比,Mesp1过表达在EB和CM分化过程中强烈诱导心脏特异性基因的表达(图5H和5I)。这些结果表明,在心脏发育过程中,Mesp1可能是linc1405的功能靶点。
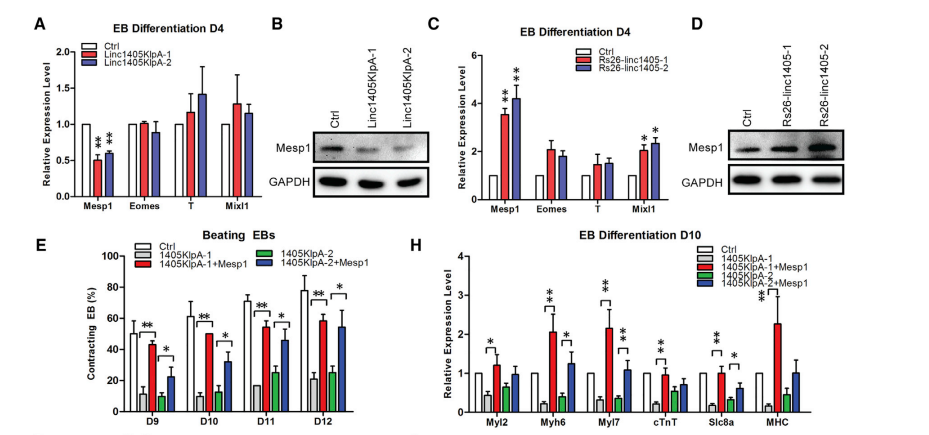
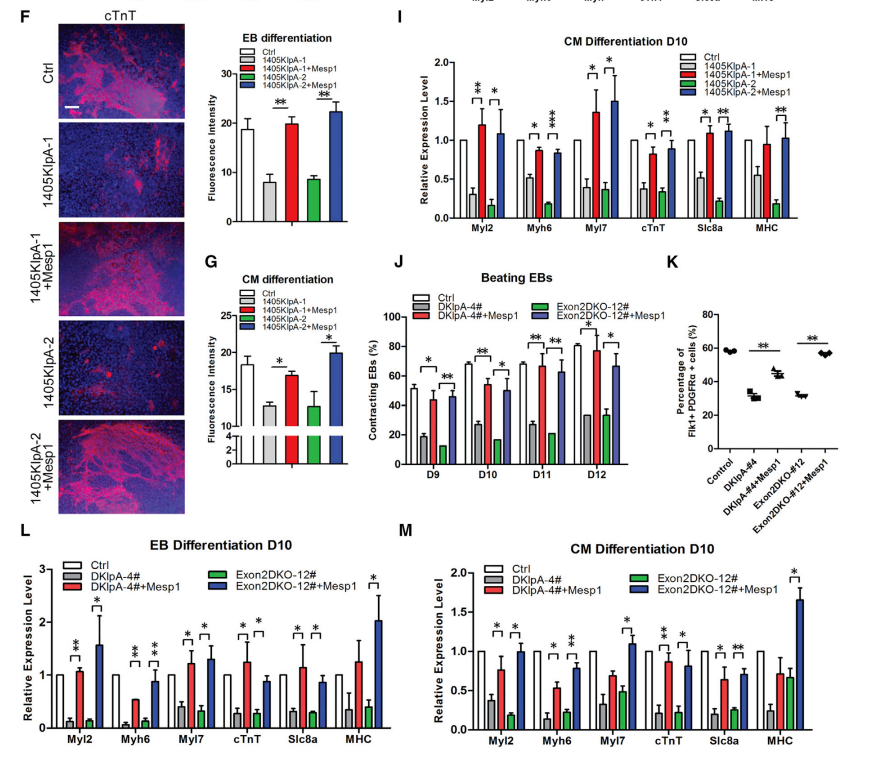
图5 Mesp1是linc1405在心脏命运决定过程中的功能靶点
6、Linc1405/Eomes将TrxG组分和GCN5组装成多蛋白复合物调控Mesp1基因增强子
小鼠中Mesp1的破坏会导致心脏发育缺陷和心脏中胚层缺陷,从而引起胚胎致死,研究数据显示,Eomes蛋白在Mesp1基因MTbx位点的富集显著降低,但在MTss位点没有显著改变(图6B和6C)。RIP实验显示linc1405与WDR5和GCN5相互作用,敲除linc1405或Eomes后,Mesp1基因MTbx位点上WDR5和GCN5的富集显著降低(图6H)。此外,当全长linc1405转录本导入到敲除linc1405的细胞时,MTbx位点Eomes、WDR5和组蛋白修饰的富集水平显著提高。这些结果表明,WDR5和GCN5被linc1405/ Eomes特异性地招募到Mesp1基因的增强子上。
共免疫沉淀(co-IP)实验的结果发现,WDR5不直接与Eomes或GCN5相互作用,而RNA pull-down实验的结果表明,linc1405的外显子2可以与WDR5和GCN5蛋白相互作用。荧光素酶实验结果表明,只有linc1405内显子2能够激活Mesp1增强子报告基因的荧光素酶活性(图6K)。结果表明,linc1405外显子2可能在Mesp1基因的增强子处介导Eomes/WDR5/GCN5复合物(图6L和6M)。
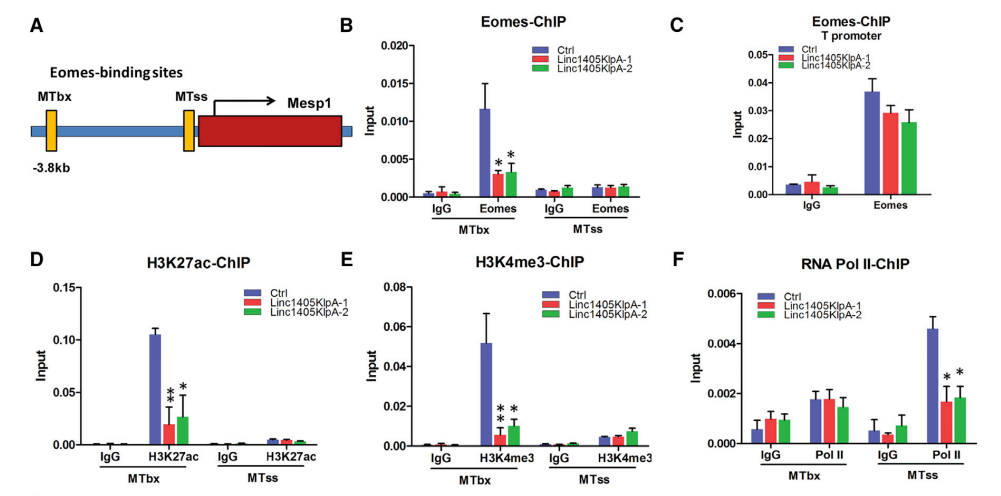
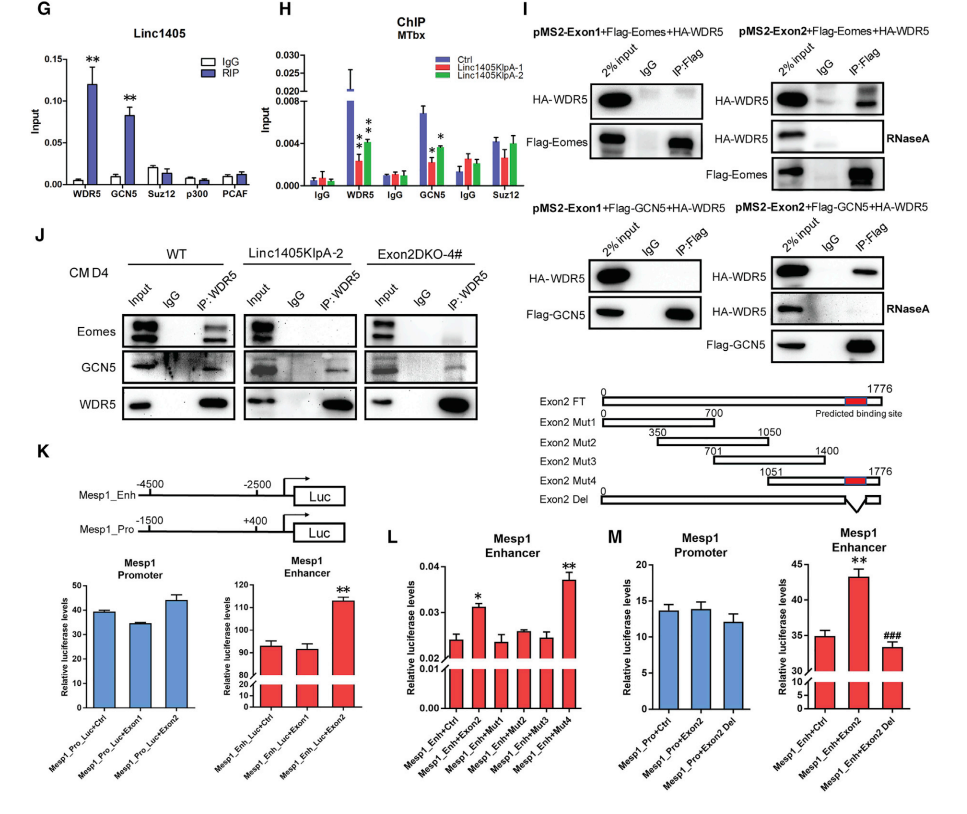
图6 Linc1405/Eomes在Mesp1基因的增强子上将TrxG组分和GCN5特异性组装成一个多蛋白调控复合体
7、Linc1405/ Eomes介导的复合物位于原条区域并调控心脏发育
Eomes在原条中表达,通过直接激活Mesp1表达促进早期心脏中胚层的形成。FISH分析显示,linc1405在胚胎的原条上表达(图7A)。WDR5和GCN5与Eomes在原条处共表达(图7B)。这些结果表明,linc1405/ Eomes与WDR5和GCN5在原条上共存。此外,构建了linc1405单基因敲除(SKO)小鼠、linc1405双基因敲除(DKO)小鼠,研究结果表明linc1405缺失导致心脏发育和功能受损。基于这些结果,提出了一个转录调控模型,其中linc1405通过联合WDR5和GCN5,调控Eomes激活Mesp1基因在原条的表达,这对正常的心脏发生至关重要(图7I)。
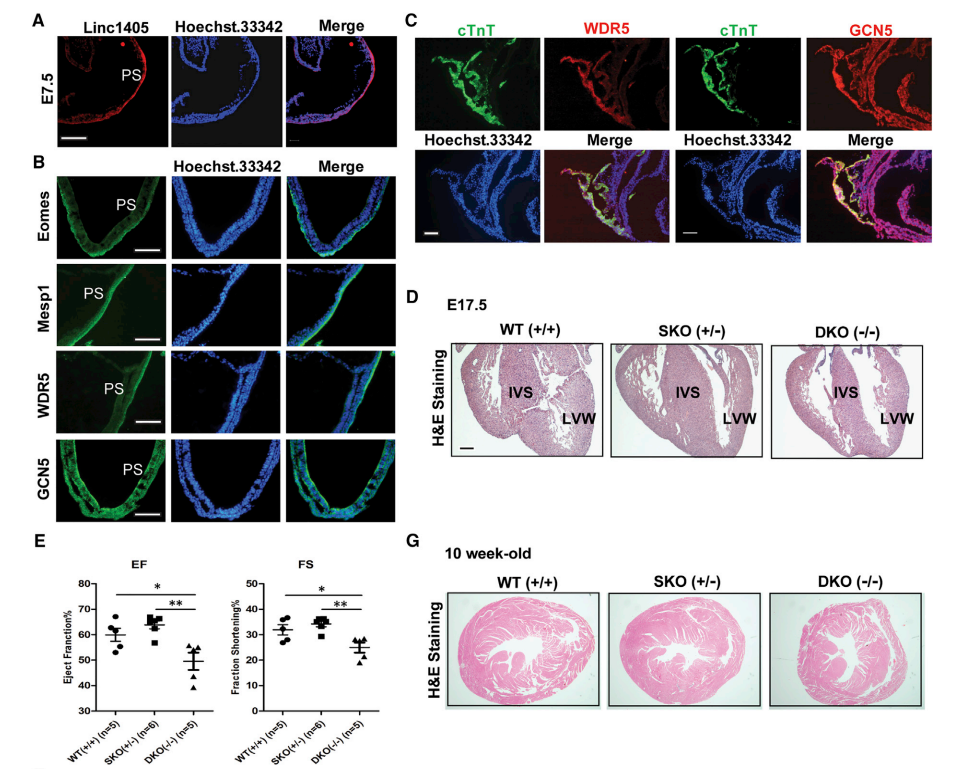
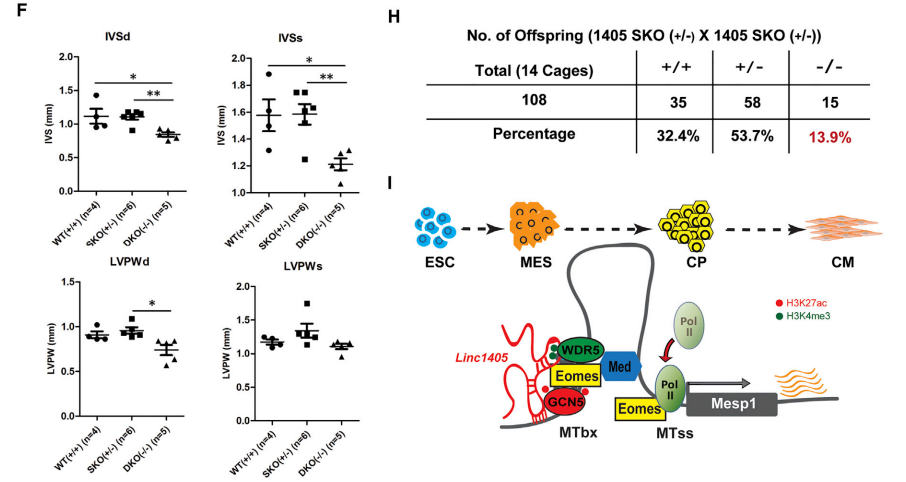
图7 Linc1405/ Eomes介导的复合体位于原始区域并协调心脏发育
三、研究结论
本研究结果表明,linc1405通过与Eomes的相互作用,来调节心脏分化的核心网络。染色质和RNA免疫沉淀实验表明,linc1405的外显子2介导了结合在Mesp1基因增强子区的复合物(该复合物由Eomes、TrxG的亚基WDR5和组蛋白乙酰转移酶GCN5组成),并在胚胎干细胞分化为心脏中胚层过程中激活其表达。同时,linc1405、Eomes、WDR5和GCN5共同定位于在原条上,且linc1405缺失会损害体内心脏的发育和功能。总之,linc1405介导Eomes/WDR5/GCN5复合物,有助于心脏发育,在体外和体内心脏发育的表观遗传调控中具有关键作用。
参考文献:
A Linc1405/Eomes Complex Promotes Cardiac Mesoderm Specification and Cardiogenesis. [J]Cell Stem Cell, 2018.